法則の辞典
「ネルンストの式」の解説
ネルンストの式【Nernst equation】
電極反応を一般的な表現として
νAA+νABB+… &lrarrow; νXX+νYY+…+ne
と表すと,それに対応する「平衡電極電位」は次の式で与えられる.
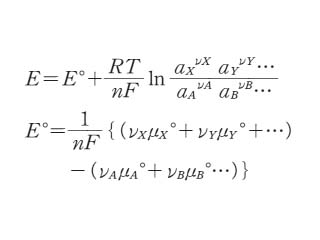
ここで ν は化学量論係数,n は電極反応に関与する電子数,a は活量濃度,μ° は標準化学ポテンシャル,R は気体定数,T は絶対温度,F はファラデー定数*である.E° は電極反応に関与する物質がすべて標準状態にあるときの平衡電極電位で,標準電極電位と呼ばれるものである.
ネルンストの式【Nernst equation】
電極の平衡電位とイオン濃度との関係を表現する式.異なった二つのイオン濃度(C1,C2)の溶液が隔膜を隔てて接しているときの平衡電位 E は次の式で表される
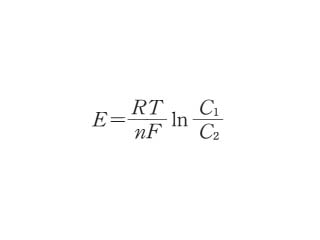
正確には C1,C2 の代わりに熱力学的濃度(活量濃度)a1,a2 を用いる必要がある.
ネルンストの式【Nernst's formula】
金属がそのイオンを含む溶液と接触したときの単極電位 E は次の式で表せる.
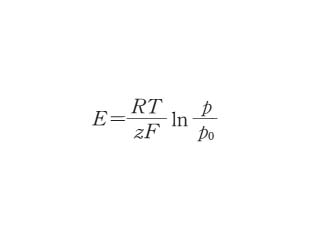
ここで R は気体定数,T は絶対温度,F はファラデー定数*,z はイオンの電荷.p は溶液の浸透圧,p0 は電溶圧である.この式をもとに活量を導入した結果「平衡電位の式」が導かれた.
ネルンストの式【Nernst's formula】
出典 朝倉書店法則の辞典について 情報
Sponserd by 
ネルンストの式
ネルンストノシキ
Nernst equation
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
世界大百科事典(旧版)内のネルンストの式の言及
【平衡電極電位】より
…電極反応Ox+ne-⇄Red(OxおよびRedは,ある酸化還元系の酸化体と還元体,e-は電子,nは反応にあずかる電子の数)に対応する平衡電極電位Eeは Ee=E゜+(RT/nF)ln(aOx/aRed)で与えられる。この関係を平衡電極電位に関するネルンストの式Nernst’s equationという。ここで,Rは気体定数,Tは絶対温度,Fはファラデー定数,aOxおよびaRedは酸化体Oxおよび還元体Redの活動度である。…
【膜電位】より
…細胞外に生じた正電荷は移動しようとするK+に逆方向の力を及ぼす結果,電気力と拡散力とがつりあい平衡に達する。平衡時に神経膜内外のK+の電気化学ポテンシャル差を0とすると,電位差はネルンストの式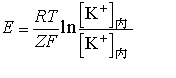 で表される(Rは気体定数,Tは絶対温度,Fはファラデー定数,Zはイオン電価数,[K+]内,[K+]外はそれぞれ細胞内,細胞外のK+の濃度)。この式から内外のK+の濃度比が10:1であれば-58mV,100:1であれば-116mVの電位差が生じることがわかる。…
で表される(Rは気体定数,Tは絶対温度,Fはファラデー定数,Zはイオン電価数,[K+]内,[K+]外はそれぞれ細胞内,細胞外のK+の濃度)。この式から内外のK+の濃度比が10:1であれば-58mV,100:1であれば-116mVの電位差が生じることがわかる。…
※「ネルンストの式」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
Sponserd by 
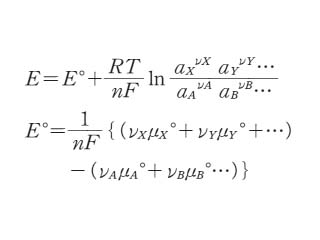
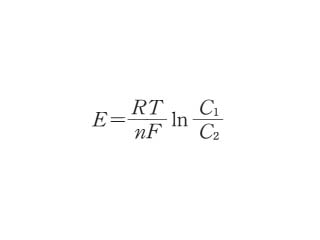
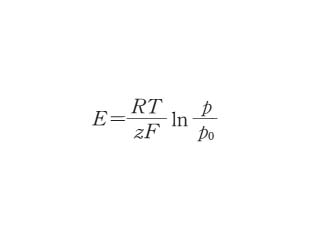


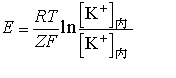 で表される(Rは気体定数,Tは絶対温度,Fはファラデー定数,Zはイオン電価数,[K+]内,[K+]外はそれぞれ細胞内,細胞外のK+の濃度)。この式から内外のK+の濃度比が10:1であれば-58mV,100:1であれば-116mVの電位差が生じることがわかる。…
で表される(Rは気体定数,Tは絶対温度,Fはファラデー定数,Zはイオン電価数,[K+]内,[K+]外はそれぞれ細胞内,細胞外のK+の濃度)。この式から内外のK+の濃度比が10:1であれば-58mV,100:1であれば-116mVの電位差が生じることがわかる。…