内科学 第10版 の解説
遺伝性ヘモクロマトーシス(ヘモクロマトーシス)
病因
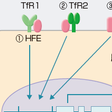
遺伝性へモクロマトーシスは,常染色体性劣性遺伝をする.へモクロマトーシスの遺伝子は6番染色体上にあり,HFE遺伝子と命名されている.HFE蛋白の機能は,細胞膜上のトランスフェリン受容体1と相互作用しトランスフェリン結合鉄の取り込みを調節している.また,肝細胞で産生される鉄代謝調節因子ヘプシジンの発現を調節している.ヘプシジンは,腸管細胞や,マクロファージからの鉄放出に関与する鉄トランスポーター蛋白フェロポルチンの発現を負に調節している.HFE関連ヘモクロマトーシスではHFE遺伝子の変異によってヘプシジンの産生が低下し,十二指腸および上部空腸粘膜のフェロポルチン増加を介して鉄吸収が持続的に亢進する.通常では1日1 mgの鉄吸収が1日3~4 mgの鉄吸収となり1年間で500~1000 mgの鉄が蓄積する.多くの例で,HFE遺伝子の282番目のチロシンがシステインに置換されているC282Yホモ接合型であるが,63番目のヒスチジンがアスパラギン酸に置換されているH63Dとの複合型(C282Y/H63D),H63Dホモ接合型も報告されている.遺伝性へモクロマトーシスはコーカソイドで頻度が高く,HFE遺伝子のホモ接合型遺伝子変異は200人に1人で,ヘテロ接合型遺伝子変異は10人に1人である.それ以外の人種では,この病型は非常にまれである.遺伝性へモクロマトーシスの病型には非HFE型がある.鉄関連遺伝子TFR2遺伝子(トランスフェリン受容体2),HAMP遺伝子(ヘプシジン),HFE2遺伝子(ヘモジュベリン)の変異によるものである.これらの遺伝子変異でもヘプシジンの発現低下または活性低下によって,腸管細胞の鉄吸収が亢進するHFE関連ヘモクロマトーシスと同じ病態を呈する.HAMP遺伝子とHFE2遺伝子変異は若年発症型である.また,フェロポルチン病はヘプシジンの標的蛋白のフェロポルチンをコードするSLC40A1遺伝子の変異が原因で,マクロファージに鉄が過剰蓄積する病型である(図13-6-4).
病態
遺伝性ヘモクロマトーシスでは肝,膵,内分泌臓器の実質細胞,心臓の心筋細胞・刺激伝導系細胞,関節の滑膜細胞・軟骨細胞に鉄沈着と線維化を起こす.主要な臨床症状も含めて表13-6-3に示す.病状が進展すると,肝硬変,糖尿病,心不全などの各種臓器不全症状だけでなく,肝発癌を起こす.検査所見では,血清鉄上昇(180 μg/dL以上),トランスフェリン飽和率(血清鉄/総鉄結合能×100)上昇(しばしば60%以上),血清フェリチンの著明な上昇(500 ng/mL以上,しばしば1000 ng/mL以上)を示す.一般に50歳を過ぎてから発症する.常染色体劣性遺伝の疾患であるが女性よりも男性に多い.女性は月経によって定期的に失血するためである.女性では閉経以前の発症はまれである.
診断
近年では,必ずしもヘモクロマトーシスの古典的3主徴である肝硬変,ブロンズ様皮膚色素沈着,糖尿病がすべて認められることはなく,健診あるいは他疾患の診療時に偶然発見されることが多くなっている.ヘモクロマトーシスのスクリーニング検査として有用なのは,血清鉄,血清フェリチンとトランスフェリン飽和率などの血清鉄マーカーである.早期診断のためには,血清フェリチンが男性で300 ng/mL以上,女性で200 ng/mL以上,かつトランスフェリン飽和率45~60%以上で,血清鉄の上昇をきたすほかの肝疾患,血液疾患が除外された場合は遺伝性へモクロマトーシスを疑うべきである.欧米ではHFE遺伝子のゲノタイプ解析を行うことが推奨されている.
組織への鉄の沈着を確認する方法としては,肝生検をして,鉄染色(Perls’ Prussian blue染色)によって光学顕微鏡で見ることが行われる.血清フェリチンが1000 ng/mL以上または血清トランスアミナーゼ値上昇がある例では肝組織の鉄沈着および線維化の程度を評価するために肝生検を行う.生検肝組織の鉄染色でびまん性に小葉内の肝細胞に鉄沈着が認められる強陽性の場合にはヘモクロマトーシスと診断されるが,それ以下の場合は二次性鉄過剰症を考える必要がある.比色法または原子吸光分析法による肝内鉄濃度の測定またはhepatic iron index(肝内鉄濃度 μmole/g肝乾燥重量/年齢)はヘモクロマトーシス診断の決め手となる.肝内鉄濃度の正常は300~1500 μg/g肝乾燥重量(5~27 μmol/g肝乾燥重量)であり,ほとんどのヘモクロマトーシスは10000 μg/g肝乾燥重量をこえる.二次性鉄過剰症ではhepatic iron indexが1.9をこえることはきわめてまれであるが,遺伝性ヘモクロマトーシスでは無症候性でも1.9をこえる(表13-6-4).CT・MRI検査で肝臓を観察する方法も有用性が高い.
治療
体内に沈着している鉄を除去するために瀉血療法を実施する.1回に200~400 mLの瀉血を週に1~2回実施する.1 gのヘモグロビンには3.4 mgの鉄が含まれており,400 mLの瀉血によって200 mgの鉄が除去される.ヘモクロマトーシスでは全身に蓄積している鉄量が30~40 gに達していると考えられるので,週1回400 mLの瀉血を3~4年続ける必要がある.治療の目標としては,血清フェリチン50 ng/mL以下,トランスフェリン飽和率30%以下を目指す.
瀉血療法ができない場合にはメシル酸デフェロキサミンなどの鉄キレート療法が推奨される.メシル酸デフェロキサミン投与は瀉血療法よりもはるかに効率が悪い.飲酒は鉄沈着を増悪させるので,禁酒すべきである.肝硬変,糖尿病に陥る以前に瀉血療法を始めた場合は,健常人とほぼ同様の寿命を保つ.糖尿病を発症している場合は,糖尿病の治療も行う.なお,新しい経口の鉄キレート剤の開発も進んでいる.[高後 裕]
■文献
Bacon BR, Adams PC, et al: Diagnosis and management of hemochromatosis: 2011 practice guideline by the American Association for the Study of Liver Diseases. Hepatology, 54: 328-343, 2011.Adams PC: Hemochromatosis. In: Zakim and Boyer’s Hepatology A Textbook of Liver Disease, 6th ed, pp1127-1144, Elsevier, Philadelphia, 2012.
戸田剛太郎:ヘモクロマトーシス.肝臓病学(井廻道夫,熊田博光,他編).pp350-361,朝倉書店,東京,2006.
出典 内科学 第10版内科学 第10版について 情報