内科学 第10版 「代謝調節」の解説
代謝調節(総論(代謝・栄養の異常))
生体はさまざまな外的・内的環境の変化に応じて細胞・臓器の機能を適応させ,ホメオスターシスを維持する.そこでは,エネルギー代謝,糖質・蛋白質・脂質などの代謝が巧妙な調節を受けている.動物においては,内分泌系と神経系が代謝調節の要となっている.これらによって個々の細胞内の代謝が調節を受け,細胞の機能的集団である組織・臓器が全体として一定の調節を受ける.さらに,臓器の働きにより個体レベルでのホメオスターシスが維持される.このために,各段階において正・負のフィードバック機構により統合のとれた精緻な調節が実現されている.
内分泌系は,古典的には内分泌組織からそれぞれに特異的なホルモンが分泌され,標的組織の細胞表面上,または,細胞質(核)内の特異的な受容体に結合して,作用を発揮する.最近では,古典的な内分泌臓器のみならず,消化管粘膜などに存在する内分泌細胞や,脂肪細胞,骨格筋・心筋などからも生理活性分子が分泌され,局所で,または全身に作用して代謝調節に重要な役割を演じることも明らかになってきた.インクレチンや,レプチン,アディポネクチンなどがその代表例である.
一方,神経系においては視床下部が代謝調節の中枢となる.自律神経を介する情報,中枢神経内での神経ネットワーク,末梢からの液性因子(ホルモン),さらには,血糖レベルを代表とする代謝シグナルなどの入力を通じて情報が統合され,主として自律神経を介する出力系を経て全身の臓器,組織の機能を調節する.細胞レベルでは,神経末端から放出されるニューロトランスミッターが近傍の標的細胞の膜表面に存在する受容体に結合し,細胞機能を調節している.
(2)液性調節因子(ホルモン)を介する調節
a.インスリンによる代謝調節
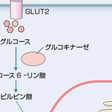
インスリンは膵Langerhans島のβ細胞から分泌され,インスリン受容体を介して多彩な作用を発揮する.後述するように主として血糖の恒常性を維持するが,脂質,蛋白質代謝にも重要な役割を演じている. 血糖値を狭い範囲(60~140 mg/dL)に厳密に維持するため,インスリンの分泌は厳格に調節を受けている(図13-1-5).生理的に最も重要なインスリン分泌刺激物質はブドウ糖(グルコース)である.細胞外液に存在するブドウ糖は,β細胞膜上に存在する促通拡散型糖輸送担体GLUT2により濃度勾配に従って細胞内に取り込まれ,細胞内外のブドウ糖濃度は直ちに平衡に達する.細胞内に取り込まれたブドウ糖は解糖系-TCA回路を経て代謝され,産生されるATP(ATP/ADP比)の変化がインスリン分泌への一次シグナルとなる.β細胞での糖代謝の律速段階はグルコキナーゼによる反応で,グルコキナーゼは「ブドウ糖センサー」の役割を果たしている.ブドウ糖の代謝により細胞内のATP濃度が上昇すると細胞膜に存在するATP感受性カリウムチャネルが閉鎖され,細胞膜電位の脱分極をきたす.これによって電位依存性のカルシウムチャネルが開口し,細胞外からのカルシウム流入によるカルシウム濃度の上昇がインスリン分泌を引き起こす(惹起経路).さらにインスリン分泌は,種々の因子による修飾を受ける.小腸粘膜に存在するL細胞,K細胞からは食物の摂取によりそれぞれGLP-1,GIPが分泌される(これらはインクレチンとよばれる).それぞれβ細胞膜に存在する特異的な受容体を介してアデニル酸シクラーゼを活性化し,cAMP,PKAの活性化を介して血糖値依存性にインスリン分泌を増強する.遊離脂肪酸は,同じく細胞膜に存在するG蛋白(Gq)共役型受容体(GPR40)を介してホスホリパーゼCを活性化し,ジアシルグリセロール,イノシトール3リン酸の産生を介してインスリン分泌を促進する.その他,インスリン分泌はアミノ酸や,自律神経系を介する調節も受けている. インスリンは標的細胞で,インスリン受容体を介して作用を発揮する.代謝作用の点では肝細胞,脂肪細胞,骨格筋細胞が標的細胞として重要であるが,インスリンはまた成長因子としての役割をもち,細胞の生存や増殖に必須で,受容体はすべての細胞に存在する.
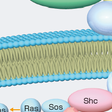
インスリン受容体はα,βの2つのサブユニット2個ずつからなる四量体で構成される.2種類のサブユニットはジスルフィド結合で結ばれ,αサブユニットは細胞外に存在してインスリンを結合する.βサブユニットには膜貫通ドメインが存在し,細胞質内のドメインがチロシンキナーゼ活性をもつ.インスリンが結合するとこのチロシンキナーゼが活性化され,自身のチロシン残基がリン酸化される(自己リン酸化)ことによりさらにチロシンキナーゼ活性が増強される.代謝調節においては,続いてIRS(insulin receptor substrate)蛋白がリン酸化され,phosphatidylinositol 3-kinase(PI-3K),PDK-1,AKTと続くリン酸化のカスケードによりシグナルが伝達される.一方,増殖作用はRas-Raf-MAPKの経路により伝達される(図13-1-6).
インスリンは,糖,脂質,アミノ酸代謝の調節に重要な役割を演じている.なかでも,血糖を低下させる唯一のホルモンであり,糖代謝の恒常性維持にきわめて重要である.骨格筋,脂肪細胞ではインスリン作用により直ちに4型糖輸送担体(GLUT4)が細胞内から細胞膜へトランスロケーションし,ブドウ糖の取り込みが促進される(図13-1-7).ついで,これらの組織および肝臓でグリコーゲン合成酵素の活性化によるグリコーゲン合成の促進,PEP-CKやグルコース-6ホスファターゼの抑制による糖新生抑制,ピルビン酸キナーゼや肝でのグルコキナーゼの誘導などによる解糖系の促進,アセチルCoAカルボキシラーゼの活性化などによる脂肪酸合成と貯蔵促進により,血糖値を低下させ,グリコーゲンや脂肪酸の蓄積を促進する.また,脂肪酸のβ酸化やケトン体合成を抑制する.同時に,脂肪組織でのホルモン感受性リパーゼの活性抑制により中性脂肪の分解,遊離脂肪酸の放出は抑制される.また,リポ蛋白リパーゼの活性化により,血清中のVLDLやカイロミクロン中の中性脂肪は加水分解され,これによって生じた遊離脂肪酸,グリセロールは脂肪組織に取り込まれて再び中性脂肪として蓄えられる.また,蛋白質の異化を抑制し,糖新生性アミノ酸(アラニンなど)の供給を減じる.インスリンのおもな代謝作用を表13-1-7,13-1-8にまとめた.
b.グルカゴンによる代謝調節
グルカゴンは膵Langerhans島のα細胞から分泌される.細胞膜に存在するGs蛋白共役型の受容体を介してアデニル酸シクラーゼを活性化してcAMPを産生,cAMP依存性蛋白リン酸化酵素(プロテインキナーゼA,PKA)を活性化する.その作用はインスリンに拮抗的で,肝臓ではホスホリラーゼを活性化してグリコーゲン分解を促進し,また,解糖系の抑制,糖新生の促進によって肝からの糖放出を促進し,血糖値を上昇させる.脂肪酸の合成は抑制され,β酸化,ケトン体合成は促進される. グルカゴンの分泌は血糖値の低下により促進され,高血糖で抑制される.糖尿病患者では相対的にグルカゴン濃度が上昇しており,血糖上昇によるグルカゴンの抑制もみられないか不完全である.小腸のL-細胞から分泌されるGLP-1は血糖依存性にインスリン分泌を促進すると同時にグルカゴン分泌を抑制する作用をもち,糖代謝調節上の重要性が注目されている.糖尿病治療薬として用いられるGLP-1受容体アゴニストやdipeptidyl peptidase-4(DPP-4)阻害薬(GLP-1の分解阻害)の血糖降下作用は,一部はグルカゴン分泌の抑制によると考えられている.
c.その他のホルモンによる代謝調節
カテコールアミン,グルココルチコイド,成長ホルモンは,グルカゴンと並んでインスリン拮抗ホルモンとよばれる.
カテコールアミンは肝でホスホリラーゼを活性化し,グリコーゲン分解を促進,血糖上昇を促す.筋ではグリコーゲン分解によりブドウ糖を解糖系に供給する.また,脂肪細胞においてホルモン感受性リパーゼの活性化により,遊離脂肪酸を血中に放出する.
グルココルチコイドは肝でグリコーゲン合成を促進し,分解を抑制するが,一方,糖新生を促進して肝からの糖放出を高める.また,脂肪分解,蛋白質の異化を促進するなどインスリン作用に拮抗する.グルカゴンやアドレナリンが糖新生や脂肪分解促進作用を発揮するためにもグルココルチコイドが必要である(許容作用).慢性作用では脂肪細胞の分化を促進し,特有の肥満を誘発する.
成長ホルモンは脂肪分解と脂肪酸の酸化を促進する.また,ケトン体産生も促進する.糖代謝にも大きな影響をもち,肝での糖放出を増加させる一方,インスリンに拮抗して全身での糖利用を抑制する.結果として血糖は上昇に働き,事実,成長ホルモンの過剰である先端巨大症の患者では糖尿病をしばしば合併する.蛋白質同化作用は成長ホルモンの本来の働きである.IGF-1を介して,また直接作用としてアミノ酸の取り込みと蛋白質合成を促進する.
d.アディポカイン,ミオカイン
脂肪組織は長くエネルギーの貯蔵組織と考えられていたが,現在ではより積極的にエネルギー代謝にかかわることがわかってきた.遺伝性の肥満モデルマウスとして知られていたob/obマウスの原因遺伝子として同定されたレプチンが脂肪細胞で特異的に発現,分泌され,食欲の調節にかかわることはこの領域での画期的発見であった.レプチンは食欲の調節のみならず,多くの代謝調節にかかわることが知られている.さらに,脂肪細胞はTNF,IL-1βなど多くのサイトカインを分泌し,インスリン抵抗性を惹起する.一方で,小型の脂肪細胞からは動脈硬化抑制,耐糖能改善作用などをもつアディポネクチンが分泌される.これら脂肪細胞由来の生理活性因子については【⇨12-14】に詳述されている.
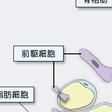
骨格筋もまた,生理活性因子を分泌し,代謝調節に関与することが明らかになってきた.骨格筋は,生体内で最大のインスリン感受性臓器であるとともに,運動によりインスリン非依存性に糖取り込みを促進する.その過程で,筋細胞でのAMPキナーゼの活性化が重要な役割を演じると考えられている.同時に運動時にIL-6をはじめとするサイトカインを分泌することが明らかとなり,免疫や代謝に影響を与えることが示唆されている.IL-6は脂肪細胞から分泌されインスリン抵抗性を惹起する一方,骨格筋からも運動時に分泌が著増することが知られていた.しかしながら,その役割についてはいろいろと議論があった.最近,骨格筋からのIL-6がGLP-1の分泌促進を介してインスリン分泌を増強し,耐糖能を改善することが報告されている.また,同様に,運動時に骨格筋からアイリシンと名づけられたペプチドが分泌されることが発見された.アイリシンは脂肪組織に作用して前駆細胞を褐色脂肪細胞の性質をもつ細胞に分化させることによりエネルギー代謝を高め,耐糖能を改善することが示され注目を集めている(図13-1-8).
(3)神経系を介する代謝調節
a.視床下部-自律神経
自律神経は消化管の運動調節を介して,または副腎や膵臓内・外分泌腺の活動調節を介して代謝調節に関与する.副交感神経の活動は腸管平滑筋の活動を亢進させ,胃液分泌の増加,幽門括約筋の弛緩などを通して食物の消化,吸収を助ける.このため,同化性神経系とよばれる.一方,交感神経系は緊急事態に対処すべく,血糖や血中遊離脂肪酸を上昇させエネルギーを供給するとともに,心拍数の増大,血圧の上昇により,筋肉や主要臓器への血流を増加させる.「逃走あるいは闘争への準備」とも称されることがあるが,平常時にも,空腹時には交感神経の活動は減少し,摂食時には活動が亢進する.このように,絶食・摂食サイクルにおいても代謝調節にかかわっている. 自律神経節前ニューロンに直接投射するのは視床下部室傍核,傍小脳脚核,孤束核,延髄腹外側部,延髄縫線核などであるが,大脳皮質,扁桃体,中脳水道周囲灰白質などからも間接的に投射する.視床下部はおもに摂食,情動のようなより複雑な反応にかかわり,その一部として自律神経系の活動を調節する.
b.神経系を介する臓器間ネットワーク
前述のように,エネルギー代謝調節は臓器間のネットワークにより調節を受けている.古典的には,インスリンに代表される液性因子を介して,内分泌器官が複数の標的器官を調節することが知られている.加えて,脂肪細胞や腸管粘膜の内分泌細胞,さらには骨格筋細胞もレプチン,アディポネクチン,インクレチン,アイリシンなどを介して中枢神経系を含めた複数臓器を調節し,臓器間ネットワークを形成する.
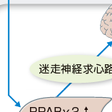
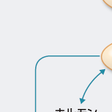
加えて,最近,求心性神経経路を介する神経シグナルも臓器間の代謝調節に大きく関与することが明らかになってきた.求心性神経回路を経て中枢神経にさまざまな代謝情報が伝達され,そこで統合されて遠心路を介して再び末梢臓器へと出力されることにより,各臓器が協調的に制御される. 胃や消化管から分泌される種々のペプチド,たとえばCCKやGLP-1,グレリンのシグナルは血流および迷走神経求心路を介して中枢神経系に伝えられる.さらには,肝臓や脂肪組織からも求心路を介してシグナルが伝達される.肥満時に,肝臓では異所性にPPARγの発現が亢進し,脂肪肝をきたす.PPARγの活性化はエネルギー蓄積過剰のシグナルとして迷走神経求心路を介して脳に伝達され,交感神経を活性化し,エネルギー消費を増大させる(図13-1-9).脂肪組織では白色脂肪細胞でのUCP1遺伝子発現が増加するが,UCP1を脂肪細胞で強制的に発現させるとやはり求心性神経経路を介してシグナルが伝達され,視床下部でのレプチン感受性が改善し,食欲抑制効果がみられる.肝臓では肥満時にERKが活性化されているが,そのERKを肝で人工的に強制発現すると,膵Langerhans島でβ細胞の過形成が認められた.インスリン抵抗性によって膵島の過形成が引き起こされるメカニズムの一部を説明するものと考えられる.このように,臓器からのシグナルが求心性神経経路を介して脳(視床下部)に伝達され,そこからのシグナルが遠心路を介して臓器での代謝を調節する.代謝調節上の重要なネットワークの1つである.
(4)時計遺伝子と代謝制御
a.時計遺伝子による概日リズムと代謝調節
生体は概日リズムをもって活動を行っている.通常,外環境における昼夜の光の周期に同調し,制御を受けている.ACTH-コルチゾールや成長ホルモンなどの分泌には概日リズムが存在し,それが代謝にも影響を与えていることは古くから知られている.また,概日リズムの変調が種々の代謝異常をきたしうることも知られ,シフトワーカーでは肥満や脂質代謝異常などが有意に高頻度となる.
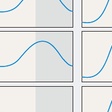
この概日リズムを形作るのが「体内時計」であるが,最近の研究により体内時計の分子機構が明らかになってきた.生体時計の中枢は視交叉上核にあり,ここで発現される転写因子である時計遺伝子がフィードバックループを形成してほぼ24時間周期で自律的な発現リズムを形成する(図13-1-10).時計遺伝子でもコアとなるのがClock/Bmal1およびPer1-3/Cry1-2である.CLOCK,BMAL1は転写促進因子であり,これらによって発現が制御される転写因子PER,CRYはCLOCK,BMAL1に対して抑制的に作用する.つまり,CLOCK/BMAL1のヘテロダイマーがPer,Cry遺伝子プロモーターに結合してその転写を促進する.その結果,PER,CRYが蓄積すると,Clock,Bmal1遺伝子の発現を抑制する,という負のフィードバックループを形成し,細胞内でこれらの遺伝子の自律的な発現リズムが形成されるのである.このフィードバックループはさらに,同じくCLOCK/BMAL1によって発現調節される核内受容体RORα,REV-ERBαによってBmal1がそれぞれ促進的,および抑制的に調節され,リズムはさらに安定化される.視交叉上核においては網膜から投射される明暗の光情報が外的時間情報として入力され,個々の細胞での概日リズムを同調させている.光情報以外にも,摂食などの因子によりこのリズムの位相が同調されると考えられている.視索上核での同調シグナルは,視索上核外のニューロン,さらには末梢器官の時計遺伝子の律動的発現を同期させる.視交叉上核からは視床下部内外の広範囲の神経核へと神経突起が投射されている.概日リズムはそれらの神経核に伝達され,そこから睡眠・覚醒,摂食などの行動,体重の維持,さらには自律神経活性やホルモンを介してエネルギー代謝,糖代謝,脂質代謝などを制御する(図13-1-11).たとえばClock変異マウスは肥満,高血糖,低インスリン血症,脂肪肝などを呈する.また,正常の動物,あるいはヒトにおいても自由摂食下では血糖値は覚醒早期に最大となる日内変動を示す.動物実験によるとこの変動はインスリンやグルカゴン,成長ホルモンの分泌パターンに依存しない.肝への交感神経切断ではコルチゾールの日内変動は変化しないが,血糖変動は消失する.視交叉上核の破壊では,血糖変動を含め,コルチコステロン,インスリン,グルカゴンの日内変動も消失する(図13-1-12).脂質代謝においても小腸からの脂質の吸収やde novoの脂質合成に概日変動が知られており,また,脂肪細胞由来のホルモンであるアディポネクチンやレプチンの分泌も同様である.
時計遺伝子が代謝調節にかかわると同時に,代謝も時計遺伝子の制御にかかわる.高脂肪食摂取は摂食の概日リズムを変化させ,肝臓,脂肪組織,視床下部での代謝関連遺伝子の変動の振幅を小さくし,位相を変化させる.肥満糖尿病モデルであるdb/dbマウスでは活動や睡眠覚醒の概日周期が障害されている.
b.末梢器官における時計遺伝子と代謝調節
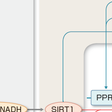
時計遺伝子の発現は,中枢神経のみならず,末梢器官のほとんどすべての細胞においても発現されている.興味深いことに,末梢においては,NAD+,NAMPT,SIRT1,AMPKなどの代謝・栄養状態のセンサーやPPARsともフィードバックループを形成している(図13-1-10).NADHはCLOCK/BMAL1ヘテロダイマーの転写活性を増強し,NAD+は抑制する.カロリー制限により誘導されるNAD+依存性脱アセチル化酵素であるSIRT1はCLOCK/BMAL1に直接結合して時計遺伝子の発現を調節する.細胞内エネルギーセンサーであるAMPKはCRY1をリン酸化し,分解を促進するとともに,NAD+生合成の律速酵素であるNAMPTを活性化する.PGC1αやPPARsもまた,CLOCK/BMAL1により発現が制御され,また,逆にBmal1の発現を調節することが示されている.実際,肝臓や膵Langerhans島における時計遺伝子の発現は摂食,絶食サイクルによって制御を受けている.
組織特異的な遺伝子改変により末梢器官での時計遺伝子の役割が明らかになっている.肝でのBmal1の欠失は低血糖をきたす一方,膵Langerhans島でのBmal1の欠失は高血糖とブドウ糖応答性のインスリン分泌障害を呈した.しかしながら,これらの興味ある現象は末梢器官での概日リズムの障害によるのか,その他の機構を介するものかは必ずしも明らかでなく,今後解明が必要である. 時計遺伝子は糖,脂質,およびエネルギー代謝調節の新たなメカニズムとして重要であることは疑いない.末梢での概日周期の調整因子,中枢と末梢の時計遺伝子制御をコーディネートするメカニズム,ヒトの健康や疾病との関連など,さらに解明されていくことが期待される.[谷澤幸生]
出典 内科学 第10版内科学 第10版について 情報