改訂新版 世界大百科事典 「求電子反応」の意味・わかりやすい解説
求電子反応 (きゅうでんしはんのう)
electrophilic reaction
イオン反応の一種。親電子反応,カチオノイド反応cationoid reactionともいう。一般に陽イオン(水素イオンH⁺やニトロニウムイオンNO2⁺など)やルイス酸(塩化アルミニウムAlCl3やフッ化ホウ素BF3など)の求電子試薬が基質の不飽和結合や非共有電子対を攻撃する段階が反応の中心となる。
求電子反応は,(1)試薬(の一部)が基質の一部と置換する求電子置換反応と,(2)試薬が基質の多重結合に付加する求電子付加反応に大別される。求電子置換反応は芳香族化合物に起こりやすい。代表的な例は,濃硝酸と濃硫酸との混酸によるベンゼンのニトロ化である。この場合の求電子試薬はNO2⁺である。反応の第1段階はNO2⁺のベンゼンへの付加によるベンゼニウムイオン中間体の生成である。この中間体ではベンゼンのもつ芳香族性が失われているので不安定であり,容易にプロトンH⁺を失ってニトロベンゼンとなる。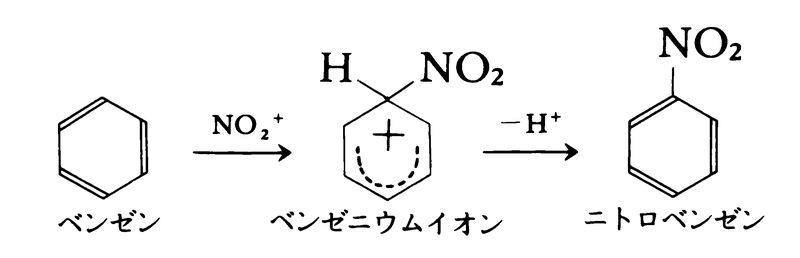
置換ベンゼンでは,ニトロ基が導入される位置は置換基の種類によって異なる。置換基がヒドロキシ-OH,メトキシ-OCH3,アミノ-NH2,メチル-CH3などの電子供与基またはハロゲンのとき,ニトロ基は置換基のオルト位またはパラ位に入る。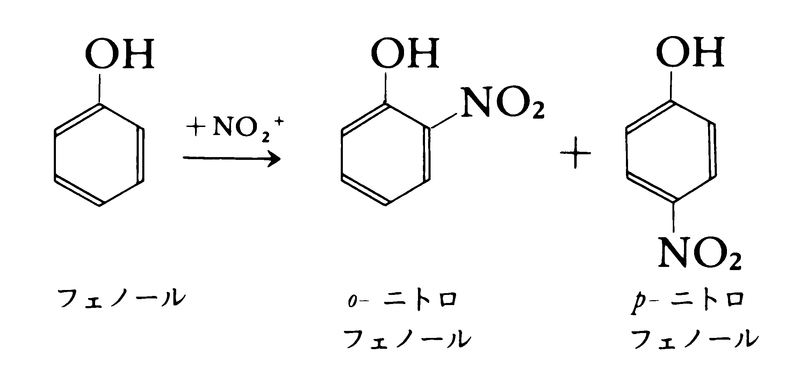
これに対して置換基がカルボキシ-COOH,シアノ-CN,ニトロ-NO2などの電子求引基のときにはニトロ基はメタ位に入る。置換基の配向性は求電子試薬の種類によらない。ベンゼン以外の芳香族化合物でも求電子置換は起こる。置換の起こる位置や置換基の配向性は,分子軌道法による電子密度の計算でかなり正確に予測できる。
不飽和結合をもつ脂肪族化合物においても,求電子反応の第1段階は求電子試薬の付加である。典型的な例はエチレンに対する臭素の付加である。求電子試薬ブロモニウムイオンBr⁺がエチレンとπ錯体をつくり,これを臭化物イオンBr⁻が攻撃し,結合をつくる。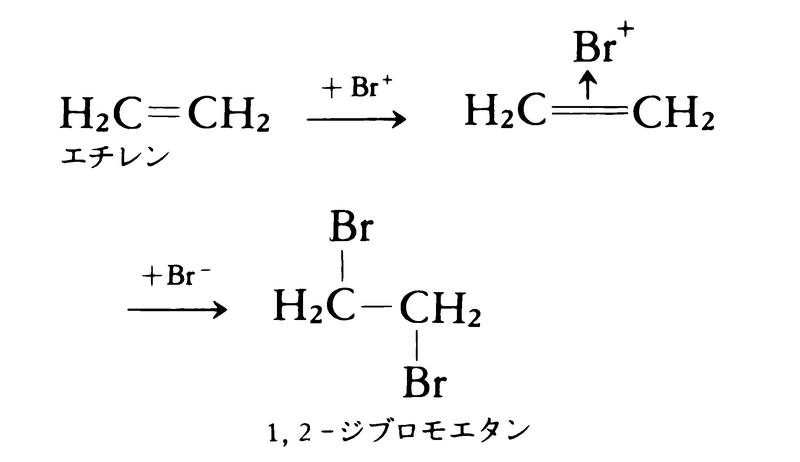
Br⁺とBr⁻はエチレン分子の平面に関して反対側から結合をつくるので,この型の付加をトランス付加という。
執筆者:竹内 敬人
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報

