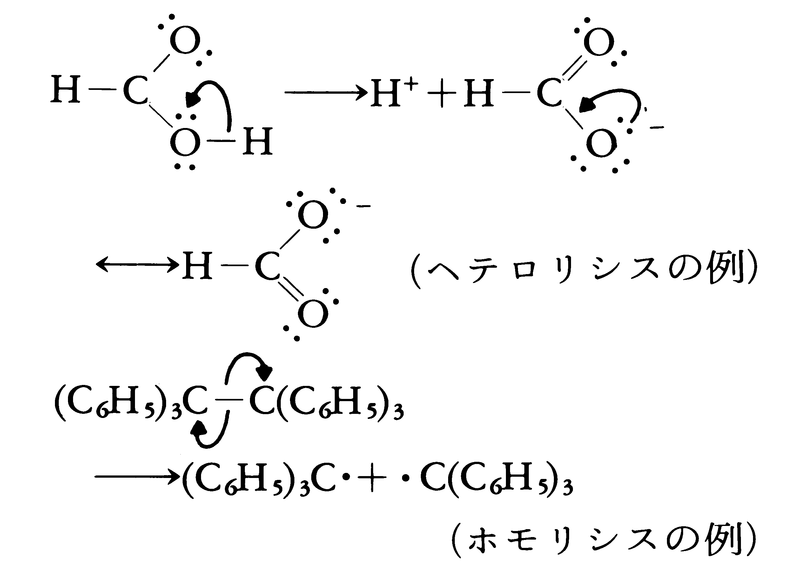イオン反応 (イオンはんのう)
ionic reaction
(1)イオンの関与する反応の総称。気相,液相,固相すべてでみられるが,最もふつうにみられるのは電解質水溶液の場合であって,ここではそのほとんどがイオン反応である。そのほか,電極でのイオンの放電を含む電極反応,融解塩での反応,酸塩基触媒反応,放射線照射によって生ずるイオンが関係する反応,高温でのイオン移動による固相反応などもイオン反応である。たとえば電解質水溶液中での反応には,塩の複分解(式(1)),巨大分子の生成(式(2)),金属と酸の反応(式(3)),錯イオン生成反応(式(4))などがある。
Na2SO4+BaCl2─→2NaCl+BaSO4 ……(1)
Zn2⁺+S2⁻─→ZnS ……(2)
Zn+2H⁺─→Zn2⁺+H2 ……(3)
Hg2⁺+4I⁻─→HgI42⁻ ……(4)
一般に溶液中の無機イオン反応の速度はきわめて速く,これまで測定されないほど速いとされていたが,最近では各種の手段によって測定されるようになってきている。
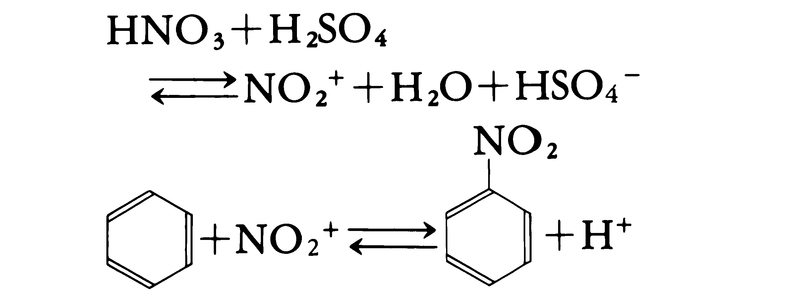
執筆者:中原 勝儼(2)原系または生成系をつくる化合物がイオンではなくても,反応の中間にイオンが生じる場合には,その反応はイオン反応に分類される。たとえばベンゼンの濃硝酸・濃硫酸混合物によるニトロ化では,反応の鍵となるのはニトロニウムイオンNO2⁺によるベンゼン環の攻撃であり,この種の反応もイオン反応に分類される。
(3)有機化学反応においては,ヘテロリシスheterolysis,極性反応polar reactionとほとんど同じ意味にも用いられる。2個の原子A,Bの間で共有結合(単結合)が開裂する場合,結合電子対をつくる2個の電子が一方の電子に与えられイオンを生ずる反応をヘテロリシス(不均等開裂と訳すこともある),これに対して,共有結合電子対をつくる2個の電子が1個ずつ両方の電子に与えられラジカル(遊離基)を生ずる反応をホモリシスhomolysis(均等開裂と訳すこともある)という。この分類は,結合の切断だけではなく,結合の生成にも適用できる。すなわち,イオン反応はラジカル反応(ホモリシス)と対をなす語であり,反応の中間に,あるいは反応生成物としてイオン種が生ずる反応一般を指す。イオン反応は,極性の大きい官能基(たとえばハロゲン,水酸基等)や多重結合をもつものに起こりやすいが,極性結合のないアルカンでは起こりにくい。
執筆者:竹内 敬人
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Sponserd by 
イオン反応
いおんはんのう
ionic reaction
イオン間あるいはイオンが関与する化学反応のことをさすが、主として電解質溶液内の反応をいう。
水溶液での反応の多くはイオン反応で、沈殿生成反応、錯生成反応、酸塩基反応、酸化還元反応などがある。イオン反応を表す化学反応式をイオン反応式とよび、たとえば硝酸銀水溶液に塩化ナトリウム水溶液を加えて塩化銀を沈殿させる反応を、
Ag++Cl-→AgCl↓
のように、反応に関与するイオンだけで書くことが多い。錯生成反応の例として、
Ni2++4CN-→[Ni(CN)4]2-
酸化還元反応の例として、
MnO4-+5Fe2++8H+
→Mn2++5Fe3++4H2O
などがある。
放射線による気体分子のイオン化や電極表面での酸化還元もイオン反応である。
[岩本振武]
有機化合物の反応において、イオン以外の物質でも反応過程でイオン性物質として作用する機構が考えられるときにはイオン反応とよぶ。たとえば無水塩化アルミニウムの存在下でベンゼンにハロゲン化アルキルを作用させてアルキルベンゼンを得るフリーデル‐クラフツ反応では、見かけ上、
C6H6+RCl→C6H5R+HCl
アルキル基が陽イオンとして作用している。このような反応をカチオノイド反応、あるいは求電子反応、親電子反応という。逆に、アセトアルデヒドにアンモニアが付加する反応では、
CH3CHO+NH3→CH3CH(OH)NH2
アルデヒド基の炭素原子に陰イオン性のアミノ基が付加しており、このような反応をアニオノイド反応、あるいは求核反応、親核反応という。
[岩本振武]
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
イオン反応
イオンハンノウ
ionic reaction
イオンの関係する化学反応の総称.水のように誘電率の大きな溶媒では電離が起こりやすいので,水溶液ではイオン反応が多く起こる.誘電率の小さな有機化合物溶液中でも,反応の中間段階ではイオンが生成していることがしばしばある.たとえば,ベンゼンをニトロ化するとき,ベンゼンと反応するのはニトロニウムイオン NO2+ である.X線やγ線などのイオン化放射線の照射によって生成するイオンの反応もある.この場合には,電子の数が奇数であるようなイオンラジカルも多く生成して反応する.とくにイオンと中性分子との反応をイオン-分子反応という.同様なことは質量分析計のイオン化室内でも起こる.イオンの反応は,イオンがクーロン力によって相手イオンあるいは分子と相互作用して起こるため,そのような相互作用のない分子どうしの反応よりも反応断面積が一般に大きい.また,溶液内のイオン反応では,イオンの活量がイオンの荷電,溶液の誘電率およびイオン強度に依存するから,反応速度もこれらの因子に影響される.溶液内のイオン反応,たとえば,
H+ + OH- → H2O
のような反応は,とくに急速なので,従来測定が容易でなかったが,温度ジャンプ法などの高速反応研究法が発達したので,測定できるようになった.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
イオン反応【イオンはんのう】
イオンのあずかる反応の総称。ラジカル反応,分子反応に対していう。電解質水溶液における陽イオンと陰イオンの反応(酸塩基反応,塩の生成反応など)はその代表例。有機化合物の反応には中間にイオンの生成する場合が多く,芳香族化合物のニトロ化,スルホン化,ハロゲン化などは,イオン反応として進行する。たとえばベンゼンのニトロ化は次に示すような過程で進行する。 HONO2+H2SO4 →NO2(+/)+H2O+HSO4(-/) NO2(+/)+C6H6→C6H5NO2+H(+/)
→関連項目有機電子論
出典 株式会社平凡社百科事典マイペディアについて 情報
Sponserd by 
イオン反応
イオンはんのう
ionic reaction
イオンが関与する化学反応。電解質水溶液の中で起る反応はほとんどイオン反応であるが,このほか非水溶媒,溶融塩中での反応,電極表面における反応,放射線反応,触媒上での反応などでも電子の移動,授受を伴うイオン反応が起ることが多い。有機化学反応はラジカル反応とイオン反応の2つの型に分類することができる。反応系または生成系を構成する物質がイオンでなくても,反応過程においてイオンが生じ,これが反応に関与するとみられる場合が多く,これも有機イオン反応という。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by 
世界大百科事典(旧版)内のイオン反応の言及
【化学反応】より
…たとえば反応, HCl+KOH―→KCl+H2Oでは,次の一連の変化, HCl―→H++Cl-,KOH―→K++OH-, H++OH-―→H2Oが起こっており,HClは酸,KOHが塩基で,この型の反応を中和反応という。 無機化合物ではイオンの関与する反応が多いが,有機化合物ではイオン反応もラジカル反応も起こる。これは反応に関与する化学結合の開裂のしかたによるもので,化学結合をつくる電子対が一方によって開裂する場合(ホモリシス)はイオン反応となり,電子対が一つずつの電子に分かれ開裂する場合(ヘテロリシス)はラジカル反応となる。…
※「イオン反応」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
Sponserd by