内科学 第10版 の解説
蛋白質・アミノ酸代謝総論(蛋白質・アミノ酸代謝異常)
a.アミノ酸
蛋白質は,体重70 kgの男性のおよそ12 kgを占める,人体の主要な要素である.蛋白質はおもに,①細胞の構造体として,②基質と一時的に結合して生体内の化学反応を起こりやすくする(触媒する)酵素として,③生体内を血流に乗って循環し,さまざまな細胞に作用を及ぼすホルモンとして,働く.
人体の蛋白質は,20種類のアミノ酸が連結してできている.アミノ酸どうしは末端(カルボキシル基)と次のアミノ酸の先端(アミノ基)とがペプチド結合によって結合する.したがって,蛋白質の先端にはアミノ基が,末端にはカルボキシル基が残り,それぞれ,N端,C端という.また,蛋白質中のアミノ酸の数を残基数ともいう.
b.アミノ酸プール
蛋白質は,炭水化物,脂質と並んで3大栄養素の1つである.しかし,炭水化物はグリコーゲン,脂質は脂肪組織の脂質(トリアシルグリセロール)として貯蔵されるのに対し,蛋白質は体内に特定の貯蔵形態をもたない.したがって,過剰に摂取された蛋白質は分解され,アミノ基を除去された後エネルギー源として利用され,その余剰はほかの2つの栄養素と同様に脂質として貯蔵される.
また,生体内で蛋白質はいつまでもそのままではいない.生体内の蛋白質はそれぞれ決まった期間で更新される.たとえば赤血球中のヘモグロビンを構成するグロビン蛋白は赤血球が寿命(120日)を迎え,肝臓や脾臓などでマクロファージによって壊されるときにアミノ酸に分解され,再利用される.一般の細胞では蛋白質分解系が複数あり,その1つにユビキチン・プロテアソーム系がある.そこでは古くなってきた蛋白質にユビキチンという小さな蛋白質の印が付けられ,そのような蛋白質はプロテアソームという,蛋白質でできた円筒形の構造物の中でエネルギー(ATP)を用いてアミノ酸に分解される.
このようにして,蛋白質が分解された遊離アミノ酸が体内に一定量存在する.細胞内と細胞外液中のすべての遊離アミノ酸をアミノ酸プールという.アミノ酸プールの量は,70 kgの男性でおよそ90~100 g程度である.アミノ酸プールには体の蛋白質を分解してできたアミノ酸のほかに,食物の蛋白質が消化・吸収されてできたアミノ酸が加わる.アミノ酸プールは体の蛋白質の合成に使われたり,エネルギーを得るために分解されたり,ほかの窒素含有化合物(たとえば核酸やポルフィリン)の前駆体となったりする.
c.蛋白質の代謝回転
このような,アミノ酸プールへのアミノ酸の出入りを蛋白質の代謝回転(ターンオーバー)という.代謝回転されるアミノ酸の量はアミノ酸プールよりも多い.健康な成人では,アミノ酸プールには毎日400 g程度,蛋白質が分解されてできたアミノ酸が入る.また,同じ量のアミノ酸が蛋白質の再合成のためにアミノ酸プールから出ていく.さらに,アミノ酸プールには1日平均100 g(0~600 g)の食事由来のアミノ酸や,体内で合成された非必須アミノ酸が流入し,1日30 g程度のアミノ酸が,窒素を含む物質の合成に用いられる.また,糖新生やケトン体生成の反応でエネルギー源となるために少量が分解され窒素は尿素として,炭素は二酸化炭素として排出される.このようにして,栄養状態良好の健康な成人では蛋白質の総量は一定に保たれる(図13-3-1).
アミノ酸プールに出入りする窒素について,体内外のバランスに注目する.窒素摂取量と,尿・汗・便としての窒素排泄量が同じであるとき,窒素バランスが保たれているという(窒素排泄量には,その他の窒素含有物質由来のものも含まれる).窒素摂取量が窒素排泄量をこえている状態,すなわち,正の窒素バランスは,組織が成長過程にあるとき(たとえば子どもや,妊娠中,消耗性疾患からの回復期)にみられる.一方,窒素排泄量が窒素摂取量よりも多い状態,すなわち,負の窒素バランスは,食事性蛋白質を十分摂取していない場合や,必須アミノ酸の欠乏,外傷,火傷,病気,手術といった肉体的なストレスの場合にみられる.
d.摂取するアミノ酸の質
食事で摂取する蛋白質の中には,必須アミノ酸を適切な割合(ヒトの組織をつくる蛋白質合成に必要な必須アミノ酸の割合と類似していること)で含んでいないものがある.たとえば,コラーゲンではいくつかの必須アミノ酸が欠乏している.また,植物性蛋白質の中では,小麦はリシンが欠乏し,インゲンマメはメチオニンが少ない.蛋白質に含まれるアミノ酸の質を評価するための指標の1つに蛋白質消化吸収率補正アミノ酸スコア(PDCAAS)がある.
e.蛋白質必要量
蛋白質必要量は,構成するアミノ酸の質による.動物性蛋白質のほうが植物性蛋白質よりも質が高いので,動物性蛋白質の摂取が多くなるほど,必要とされる蛋白質量が減少する.その違いを考慮しない場合,蛋白質の必要量は,成人の体重1 kgあたり0.8 g,つまり70 kgのヒトで56 gとされている.運動選手,妊娠または授乳中の女性,成長中の子どもでは,これより多くの量を必要とする.
一方,過剰に摂取された蛋白質は分解される.炭素骨格はエネルギー産生または脂肪合成に用いられ,アミノ基は尿中に尿素として排出される.このとき,尿中カルシウムの増加をしばしば伴い,腎結石や骨粗鬆症のリスクが増大する.
また,食事性蛋白質の必要量は,食事中の糖質量によっても左右される.糖質摂取量が少ない(1日130 g以下)と,蛋白質を分解して糖新生によって血糖値を維持するようになる.逆に,適切な量の糖質の摂取は,蛋白質をこのような目的に使わせない蛋白質節約効果をもつ.これらの観点は,低炭水化物ダイエットの是非を考えるうえで重要であろう.
(2)アミノ酸の種類
a.側鎖の性質による分類
アミノ酸の立体構造において中心となる炭素原子は水素原子,アミノ基,カルボキシル基と必ず結合することは前述した.残り1本の化学結合の相手となる側鎖の構造がアミノ酸が蛋白質の中で果たす役割を決めるうえで重要である.側鎖は非極性(電子の分布が均等)であるか,極性であるか(酸や塩基のように電子の分布に偏りがあるか)で分類される.蛋白質を構成する20種のアミノ酸をこの観点から分類すると次のようになる.
非極性側鎖をもつアミノ酸は,グリシン,アラニン,バリン,ロイシン,イソロイシン,フェニルアラニン,トリプトファン,メチオニン,プロリンである.これらのアミノ酸側鎖は,油性あるいは脂質性であり,疎水性相互作用を促す性質がある.すなわち,蛋白質の立体構造ができるときに,水溶性蛋白質の内部,あるいは,膜蛋白質の膜貫通部位に位置する傾向がある.
無電荷の極性側鎖をもつ,すなわち,中性の溶液中で正味の電荷が0であるようなアミノ酸は,セリン,スレオニン,チロシン,アスパラギン,グルタミン,システインである.これらのアミノ酸の極性の水酸基は水素結合によって蛋白質の立体構造の形成に関与している.また,システインの側鎖のスルフヒドリル基(-SH)どうしがジスルフィド結合する(このようなシステインはシスチンとよばれる)ことによって,多くの細胞外蛋白質(たとえばアルブミン,免疫グロブリン,インスリン)が安定化される.さらに,セリン,スレオニン,チロシンの極性水酸基は,リン酸基などの結合部位になることができ,蛋白質をリン酸化する酵素の基質として重要である.
酸性側鎖をもつアミノ酸はアスパラギン酸とグルタミン酸である.これらの側鎖は生理的なpHではカルボキシル基が負の電荷をもつイオンとなり,陽イオン(たとえばナトリウム)と結合して塩を形成している.一方,塩基性側鎖をもつアミノ酸(ヒスチジン,リジン,アルギニン)では,リジンとアルギニンの側鎖が常に正電荷をもつのに対し,蛋白質に組み込まれたヒスチジンの側鎖は,蛋白質での環境に依存して正に荷電したり負に荷電したりする.ヒスチジンのこの性質は,Bohr効果(ヘモグロビンはpHが低い(すなわち二酸化炭素分圧が高い)状態では酸素への親和性が低下する(酸素解離曲線が右に移動する)現象)に寄与している.
b.必須アミノ酸と非必須アミノ酸
これらの20種のアミノ酸のうち,バリン,ロイシン,イソロイシン,スレオニン,リジン,メチオニン,フェニルアラニン,トリプトファン,ヒスチジンは人体にとっての必須アミノ酸,すなわち,体内ではまったくあるいは不十分にしか生成されないので,食物からの摂取にすべてあるいはほとんどを依存しているアミノ酸,とされている.また,この意味において,幼児ではアルギニンも必須アミノ酸といえる.
その他のアミノ酸は,生体内で必要量を生成可能なので非必須アミノ酸といわれる.
c.糖原性アミノ酸とケト原性アミノ酸
アミノ酸の異化はアミノ基の除去と,残った炭素骨格の分解という経路からなる.炭素骨格の分解によってピルビン酸やクエン酸回路の中間体(特にα-ケトグルタル酸,スクシニルCoA,フマル酸,オキサロ酢酸)を生じるものは,エネルギー源としてだけでなく肝臓での糖新生や肝臓・筋肉でのグリコーゲンの生成にも用いられるので,糖原性アミノ酸という.一方,アセチルCoAまたはアセト酢酸を生じるものは糖新生やグリコーゲン生成に用いることができないのでケト原性アミノ酸という.
純粋にケト原性のアミノ酸はロイシンとリジンで,糖原性かつケト原性のアミノ酸はチロシン,イソロイシン,フェニルアラニン,トリプトファンである.その他のアミノ酸は糖原性アミノ酸である.
d.分岐鎖アミノ酸
イソロイシン,ロイシン,バリンは側鎖の形から分岐鎖アミノ酸(分枝アミノ酸)とよばれ,いずれも必須アミノ酸である.これらはほかのアミノ酸が小腸から門脈で運ばれる先の肝臓でおもに代謝されるのに対し,むしろ末梢組織(特に筋肉)で代謝され,蛋白質源としてだけでなくエネルギー源ともなる.そのため,肝硬変患者の蛋白質-エネルギー栄養失調症の改善などに用いられる.
(3)アミノ酸の消化吸収
a.蛋白質の消化
食事中の蛋白質の消化は3つの臓器(胃,膵臓,小腸)から分泌される消化酵素で行われる.まず胃では胃酸が蛋白質を変性させて分解されやすくし,ペプシンが蛋白質をペプチド(アミノ酸が連なったもの)といくらかの遊離アミノ酸に分解する.次に膵臓から十二指腸に分泌される複数種類のプロテアーゼ(トリプシン,キモトリプシン,エラスターゼ,カルボキシペプチダーゼA,B)はペプチドをさらに小さなオリゴペプチドとアミノ酸に分解する.各プロテアーゼは切断するペプチド結合に隣接するアミノ酸の側鎖に対して異なる特異性をもっている.最後に小腸で産生されるアミノペプチダーゼはオリゴペプチドを遊離アミノ酸に分解する.
このように,膵液が重要な役割を果たしているので,慢性膵炎や囊胞性線維症(OMIM:#219700)などの膵臓疾患は蛋白質消化不全を起こすことがある.
b.アミノ酸の吸収
小腸上皮はアミノペプチダーゼという酵素を分泌し,オリゴペプチドをさらに遊離アミノ酸またはジペプチド(アミノ酸が2つのペプチド),トリペプチド(アミノ酸が3つのペプチド)に分解する.遊離アミノ酸はナトリウムイオン依存性の能動輸送系によって,また,ジペプチドとトリペプチドは水素イオン依存性の輸送系によって小腸上皮細胞に取り込まれる.ジペプチドとトリペプチドは小腸上皮細胞の細胞質でアミノ酸に分解された後に門脈系に放出される.
c.アミノ酸の輸送
吸収されたアミノ酸は門脈で肝臓に運ばれ,代謝されるか,分岐鎖アミノ酸のように肝臓で処理されることなく循環血液中に放出される.
d.アミノ酸の細胞への取り込み
血液中のアミノ酸濃度は細胞内よりもかなり低いので,細胞は内部にアミノ酸を能動的に取り入れるために,ATPのエネルギーで駆動されるアミノ酸輸送系(トランスポーター)を細胞膜にもっている.トランスポーターは,アミノ酸の種類(重なりあう特異性をもつ)によって,また,ナトリウム依存性によって,多くの種類に分類される.
よく知られたアミノ酸輸送系の異常として,シスチン尿症がある.この遺伝性疾患では,シスチン,オルニチン,アルギニン,リジンの輸送系に欠陥があり,近位尿細管におけるこれらのアミノ酸の再吸収に障害が生じる.そのため,尿路にシスチンが沈着して腎結石が生じる.
(4)アミノ酸の代謝
a.蛋白質同化・異化の切り替え
食後2~4時間を消化吸収相,それ以外の空腹期間を異化相という.吸収相では,血中のグルコース,アミノ酸,トリアシルグリセロールが一過性に上昇する.そして,膵島β細胞がグルコースとアミノ酸の上昇に反応してインスリンの分泌を上昇させ,グルコースはグルカゴンの分泌を低下させる.これらのホルモンによるシグナルと,循環血液中の基質の上昇とにより,トリアシルグリセロールの合成,グリコーゲンの合成,蛋白質の合成が同時に増加する.また,肝臓でのアミノ酸の分解・アンモニア生成も同時に増加する.
一方,異化相では,血中のグルコース,アミノ酸,トリアシルグリセロールが減少する.そして,インスリンの分泌が抑制され,グルカゴンとアドレナリンの分泌が増加する.インスリンの低下とグルカゴンの上昇は肝臓での糖新生を促進し,アミノ酸プールは蛋白質の再合成よりもアミノ酸を分解して糖新生やエネルギー源として用いられるようになる.また,筋では蛋白質が分解され,肝臓での糖新生に用いられるアミノ酸が供給される.
b.アミノ基の除去
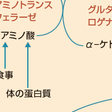
アミノ酸からアミノ基を除去する反応には,アミノ基をα-ケトグルタル酸に転移させることでアミノ基をグルタミン酸に集める反応(アミノ基転移反応)と,グルタミン酸からアミノ基をアンモニアとして遊離させる反応(酸化的脱アミノ反応)とがある.前者はほぼそれぞれのアミノ酸に特異的なアミノトランスフェラーゼ(アミノ基転移酵素)によって,後者はグルタミン酸デヒドロゲナーゼによって行われる.また,前者の反応の逆反応は,不足している非必須アミノ酸をほかのアミノ酸から生成するための反応にも用いられる.アミノ基転移反応の酵素は多くの細胞(特に肝臓,腎臓,腸管,筋肉)に存在する.一方,酸化的脱アミノ反応の酵素はおもに肝臓と腎臓に存在する.
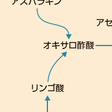
アミノ基転移反応の中で最も重要なものを2つあげると,1つはアミノ基をα-ケトグルタル酸に転移することによってアラニンをピルビン酸にするアラニンアミノトランスフェラーゼ(ALT),別名グルタミン酸-ピルビン酸トランスアミナーゼ(GPT)で,もう1つは同様にしてアスパラギン酸をオキサロ酢酸にするアスパラギン酸アミノトランスフェラーゼ(AST),別名グルタミン酸-オキサロ酢酸トランスアミナーゼ(GOT)である(図13-3-2). ALTの逆反応は後述するように筋の分解によって肝臓に糖新生のためのアミノ酸を供給するしくみにおいて重要である.また,ASTの逆反応は肝臓の尿素回路にアスパラギン酸を供給するために重要である. アミノ酸からアミノ基を除去する反応はもう1種類ある.人体内で活性をもつ(蛋白質合成に用いられたり,その他の反応に関与する)アミノ酸はすべてl-体とよばれるものだが,自然界にはそれと鏡像関係の立体構造をしたd-体のアミノ酸があり,食物を通じて摂取される.そのようなd-アミノ酸からアミノ基を除去して残った炭素骨格を利用するために,d-アミノ酸オキシダーゼという酵素が肝臓と腎臓にある.
c.アンモニアの輸送
酸化的脱アミノ反応によって生成したアンモニアは肝臓まで無害に運ばれなくてはならない.アンモニアは少量でも有害である(正常では,血中アンモニア濃度は5~10 μmol/Lと,きわめて低値)ので,ほとんどの細胞はグルタミンシンテターゼによってアンモニアをグルタミン酸と結合させ,生体に安全なグルタミンを生成して血中に放出する.
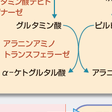
一方,筋では糖新生のためにアミノ酸が大量に分解されてアンモニアも大量に生じる.それをグルタミンとして放出するのではなくアミノ基をピルビン酸に転移して,アラニンとして放出している.肝臓はアラニンを材料として糖新生を行い,血中にグルコースを放出する.グルコースは筋や脳をはじめ多くの組織で解糖系によって分解され,アラニンの原料のピルビン酸を生じる.筋と肝との間でアラニンとグルコースの交換を伴い,このように行われる物質循環をグルコース-アラニン回路とよぶ(図13-3-3).
肝臓と筋肉との間の物質循環の例としてはほかに,運動時に筋肉で大量に発生する乳酸が肝臓で糖新生の原料として使われ,グルコースとなって筋肉に帰ってくるCori回路がある.
d.尿素回路
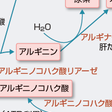
体全体の組織でアミノ酸が異化されて生じたアンモニアは,グルタミンに取り込まれて血中を安全に輸送され,肝臓に集中する.肝臓は,アンモニアの最終処理をしなくてはならない.そこで,肝細胞は,到着したグルタミンをアンモニアとグルタミン酸とに分解し,尿素回路という反応系でアンモニアを尿素という人体により無害な形に変え,血中に放出する.そして尿素は腎臓から尿中に排出される. 尿素回路は肝細胞の細胞質とミトコンドリアとにわたって行われる(図13-3-4).まず,ミトコンドリア内で,アンモニアと二酸化炭素と2分子のATPとからカルバモイルリン酸が生成される.次に,カルバモイルリン酸とオルニチンとから,シトルリンが合成され,ミトコンドリア外の細胞質に輸送される.
細胞質において,まず,シトルリンはアスパラギン酸と結合してアルギニノコハク酸になる.このときATPを1分子消費する.アスパラギン酸は,ASTの逆反応によってグルタミン酸とオキサロ酢酸からつくられる.
アルギニノコハク酸は分解されてアルギニンとフマル酸になる.アルギニンはアルギナーゼによって分解されて尿素とオルニチンを生じる.アルギナーゼによるアルギニンの分解はほとんど肝臓でしか起こらない.最後に,オルニチンはミトコンドリア内に輸送されてシトルリンの合成に用いられ,回路が一巡する.
尿素回路の全体としての反応式を考えるには,中間物質を考慮する必要はなく,
アスパラギン酸+NH3+CO2+3ATP+2H2O
→尿素+フマル酸+2ADP+AMP+2Pi+PPi
と表すことができる.広い目でみると,フマル酸はTCA回路に投入されてオキサロ酢酸となり,オキサロ酢酸はASTの逆反応でアスパラギン酸となるので,産物のフマル酸も投入物のアスパラギン酸の原料になっている(図13-3-4).
e.炭素骨格の異化:糖原性アミノ酸の場合
一方,アミノ基を除去された炭素骨格は最終的にTCA回路に投入されて二酸化炭素と水に分解され,エネルギー源として利用することができる.どのような中間体ができるかによって,(2)-cで述べたように,TCA回路の中間体またはピルビン酸を生じ,糖新生の原料となることのできる糖原性アミノ酸(図13-3-5)と,アセチル酢酸またはその前駆体であるアセトアセチルCoAを生じるケト原性アミノ酸とに分類される.
糖原性アミノ酸について(図13-3-5)補足すると,まず,アスパラギンはアスパラギナーゼによって分解されアンモニアとアスパラギン酸になる.グルタミン,プロリンはグルタミンを経てα-ケトグルタル酸になる.アルギニンは,尿素回路で使われるほかに,オルニチンを経てα-ケトグルタル酸を生じることもできる.スレオニンはアラニンのほかにアセチルCoAも生じる.フェニルアラニンはまずチロシンに変化して,チロシンは最終的にフマル酸とアセト酢酸を生じる.フェニルアラニンとチロシン代謝の酵素の遺伝子配列の異常により,フェニルケトン尿症,アルカアプトン尿症,白皮症を生じる.スレオニンはピルビン酸にもなる.また,メチオニンはホモシステインを経て,さらにセリンと結合してシステインの原料ともなる. ケト原性アミノ酸のうち,分岐鎖アミノ酸であるイソロイシン,ロイシン,バリンは肝臓よりもむしろ末梢組織(特に筋肉)で代謝されるが,共通の異化経路で代謝される.すなわち,これらの分岐鎖アミノ酸専用のアミノトランスフェラーゼ(ビタミンB6を必要とする)によってアミノ基を除去され,分岐鎖専用の酸化的脱炭酸酵素(メープルシロップ尿症で欠損している),そして共通の脱水素酵素で処理されるなど,共通の処理系を有している.[日紫喜光良]
■文献
Champe PC, Harvey RA, et al: イラストレイテッド生化学,丸善,東京,2008.
出典 内科学 第10版内科学 第10版について 情報