日本大百科全書(ニッポニカ) 「蛍光試薬」の意味・わかりやすい解説
蛍光試薬
けいこうしやく
fluorescence reagent
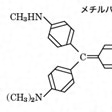
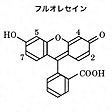
特定の物質と反応して蛍光を発するか、あるいは自らがもつ蛍光を失う消光の現象を示す試薬。このような性質をもつ物質は蛍光分析に用いられ、定性または定量分析が可能である。可視光で蛍光を発する試薬としてはフルオレセイン、エオシン、エスクリンなどの水溶液、カナリーガラス(酸化ウランを含んだガラス)などが古くから知られており、フルオレセイン、エオシンは沈殿滴定の蛍光指示薬としても利用されている。1923年ファヤンスが提唱した、硝酸銀を滴定液としてハロゲン化物イオンを滴定する方法は、ジクロロフルオレセイン、フルオレセイン、エオシンなどの蛍光指示薬を用い、当量点近傍で蛍光指示薬が沈殿に吸着し、蛍光が消失する現象を利用している。硝酸銀溶液がごくわずか過剰になると沈殿が正に帯電し、そこに蛍光指示薬が負のイオンとして吸着する。ハロゲン化物イオンを滴定液として銀イオンを滴定する場合、終点で沈殿の電荷は負となるので、正電荷の色素が吸着されて沈殿が着色する。このような色素としてメチルバイオレット、ローダミン6Gなどの塩基性指示薬が用いられる(参照)。
ハロゲン化物イオンの中性溶液を滴定するのがモール法で、ファヤンス法はかなり強い酸性でも滴定できる点が優れている。また、ポンタクロムブルーブラックRは弱酸性領域(pH4.8、励起光365ナノメートル。1ナノメートルは10億分の1メートル)でアルミニウム(Ⅲ)イオンと反応して橙(だいだい)色(波長600ナノメートル)の蛍光を発するので、アルミニウムの蛍光分析における検出試薬として用いられる。一般に蛍光測定は、紫外可視分光光度法による吸収スペクトル測定に比べて、はるかに高い感度をもち、蛍光試薬には鋭敏なものが多いが、蛍光は多くの因子によって影響を受けやすいので、蛍光分析に利用するときには使用条件を十分厳密に設定する必要がある。
塩化物イオンCl-、臭化物イオンBr-、ヨウ化物イオンI-、チオシアン酸イオンSCN-の滴定に対する指示薬の例をに示す。表中、4,5-ジクロロフルオレセインはに示したフルオレセインの構造の4と5位に塩素が二つ結合したものをさし、2,4,5,7-テトラブロモフルオレセインはフルオレセインの構造の2、4、5、7位に臭素が四つ結合したものをさす。このようにハロゲンが結合することによって、滴定の水素イオン指数pHを下げることができる。
[成澤芳男]
『日本分析化学会編『分析化学便覧』改訂3版(1981・丸善)』▽『奥谷忠雄他著『基礎教育 分析化学』(1995・東京教学社)』▽『日本光生物学協会・船津高志編『生命科学を拓く新しい光技術』(1999・共立出版)』