翻訳|indicator
精選版 日本国語大辞典 「指示薬」の意味・読み・例文・類語
日本大百科全書(ニッポニカ) 「指示薬」の意味・わかりやすい解説
指示薬
しじやく
indicator
滴定において当量点を判定するのに用いる試薬をいう。色の変化、蛍光の生成・消滅、化学発光、濁り、沈殿の生成といった現象を直接肉眼で観察することによって終点を指示するものと、物理的性質の変化によって終点を指示するものがある。
指示薬としてもっとも広く用いられているのは呈色指示薬であるが、呈色指示薬には終点において無色から有色、あるいは有色から無色に変わる一色指示薬(単色指示薬)と、終点においてある色から別の色に変わる二色指示薬がある。
[成澤芳男]
分類
指示薬が指示する反応の型により分類すると次のようになる。
(1)酸塩基指示薬 酸塩基滴定あるいは中和滴定における終点判定の指示薬として用いられ、溶液中の水素イオン濃度の変化に伴って変色するもの。この種の指示薬は、それ自身が弱酸または弱塩基の有機色素で、酸性指示薬と塩基性指示薬に分類される。一般にそのイオン(酸性指示薬であれば酸解離した指示薬陰イオン、塩基性指示薬であればプロトン付加型イオン)となったものの色と非解離型のものの色が異なり、変色は速やかで、しかも可逆的である。したがって溶液中の水素イオン濃度あるいは水素イオン指数(pH)の変化を判定することができる。指示薬はこのようにおのおの特定のpH領域(変色域という)を隔てて前後で呈色が異なるが、変色域より低いpHにおける色を酸性色、高いpHにおける色を塩基性色またはアルカリ性色という。酸塩基指示薬には変色域を2個有するものがある。
(2)酸化還元指示薬 溶液中の酸化還元反応の終点指示に用いられるもの。それ自身が電子の授受反応に関与し、酸化体と還元体の色が著しく異なる指示薬をいう。滴定に際し、酸化還元反応で生じる電位によって指示薬が迅速に酸化または還元されて変色するので、終点判定ができる。酸化還元指示薬は酸塩基指示薬に比べて種類も少なく、また電位が溶液組成などの条件で変わるので、使用条件に制限のある場合が多い。中和滴定は一般に、酸を塩基で滴定しても、塩基を酸で滴定しても酸塩基指示薬の変色は迅速かつ可逆的なので、特別な理由がなければ、いずれの方法も用いうるが、酸化還元滴定では滴定の方法は限定される場合が多い。
(3)金属指示薬 金属色素指示薬または金属変色指示薬ともいわれ、それ自身金属イオンとそれほど安定ではないキレートをつくる有機色素で、キレート滴定に用いられる指示薬である。指示薬が金属イオンと反応して生成するキレートは、指示薬自身の色と異なる色を示さなければならないし、また滴定剤であるキレート試薬と金属イオンとの間で生ずるキレートより不安定で、当量点の金属イオン指数(pM)値近傍でキレート試薬に対して金属イオンを放出しなければならない。金属指示薬は酸塩基の性質をも兼ね備えているのが普通であり、pMに対する指示薬として働くのみならず、pH指示薬としても働くので、滴定の際に金属指示薬が溶液中で呈する色をはっきり検知するためには、溶液のpH値を一定にしなければならない。溶液のpH値を一定にするのに緩衝溶液が用いられる。
(4)沈殿指示薬 沈殿滴定に用いられる指示薬で、次の三つに分類される。
(a)有色沈殿の生成(モール法) 1856年ドイツのモールKarl Friedrich Mohr(1806―1879)によって提唱された方法で、中性または微酸性溶液中の塩化物イオンあるいは臭化物イオンを銀イオンで滴定する際に加えるクロム酸塩はこの滴定における指示薬の例である。当量点を過ぎるとクロム酸銀の赤褐色沈殿が生成するので、その点を終点とする。この例のように沈殿滴定で生ずる沈殿と異なる有色沈殿を生成する指示薬の例はあまり多くない。
(b)有色錯体の生成(フォルハルト法) 1874年ドイツのフォルハルトJacob Volhard(1834―1910)により提唱された方法で、銀イオンをチオシアン酸イオンで滴定するとき加える鉄ミョウバン(硫酸鉄(Ⅲ)アンモニウムNH4Fe(SO4)2・12H2O)はこの指示薬の例である。この滴定では白色のチオシアン酸銀の沈殿が生成し、当量点を過ぎると過剰のチオシアン酸イオンは鉄(Ⅲ)イオンと可溶性の赤色錯イオン、チオシアナト鉄(Ⅲ)錯イオンを生成するので、この点を終点とする。この錯イオン生成による終点指示は鋭敏である。有色錯体生成による終点指示の例も多くない。
(c)吸着指示薬 指示薬のイオンが沈殿に吸着するとき変色がおこる。吸着指示薬は弱酸または弱塩基なので、溶液中に解離型あるいはプロトン付加型として存在するpH領域は指示薬によって異なる。吸着指示薬が沈殿滴定において作用する機構は前二者の場合と異なる。1923年アメリカのK・ファヤンスはO・ハッセルとともに、フルオレセインおよびその誘導体が銀滴定の指示薬として用いられることをみいだし、この機構を次のように説明した。塩化ナトリウムの溶液に硝酸銀を加えた場合、生じた塩化銀の沈殿粒子は溶液中に過剰に存在する塩化物イオンをその表面に吸着し、塩化銀のコロイド粒子は負に帯電することになる。このようにして生じた第一吸着層は、さらに溶液中の陽イオンを吸着して弱い結合状態の第二吸着層を形成する。
銀イオンが過剰になるまで硝酸銀を加え続けていくと、銀イオンは第一吸着層の塩化物イオンを置換して吸着するため沈殿粒子は正に帯電し、溶液中の陰イオンと弱く結合した第二吸着層を形成する。
この溶液にフルオレセイン(弱酸なのでHFlと表す)を加えると、陰イオンFl-は塩化物イオンが過剰に存在する限り塩化銀の沈殿に吸着されることはない。フルオレセインは塩化物イオンが過剰に存在していると黄緑色の蛍光を発しているが、終点直後に銀イオンが過剰になるとFl-は正に帯電した粒子の表面に吸着する。その結果沈殿はピンク色を呈し、蛍光は消失し、終点判定ができる。
滴定液として銀イオンを用いて塩化物イオンを滴定する場合、終点で沈殿の電荷は負になるので正電荷の色素が吸着されて沈殿が着色する。このような指示薬としてメチルバイオレット、ローダミン6Gなどの塩基性指示薬が用いられる。沈殿滴定の種類により、適当な吸着指示薬が選択される。
(5)蛍光指示薬 蛍光の発生または消失で滴定の終点を示す指示薬をいう。カルシウムCaをエチレンジアミン四酢酸(EDTA)で直接滴定する場合、水酸化カリウムKOHにてpH12に調整し、カルセインを指示薬として加えると、滴定終点で緑色の蛍光が消失する。この滴定法の利点は着色溶液にも適用できることである。このほかにフルオレセイン、ウンベリフェロン、ローダミンB、エオシンなどが知られている。
一般に変色指示薬より鋭敏であるが、多くの因子に影響を受けやすいので、使用条件を厳密にする必要がある。
指示薬は普通1種類のものを使うが、まれには二つ以上を混ぜて使う場合もある。このような場合を配合指示薬といい、配合指示薬には混合指示薬、遮蔽(しゃへい)指示薬(マスク指示薬)、万能指示薬などがある。混合指示薬の例としては、メチルレッド(酸性色赤、変色域pH4.2~6.3、アルカリ性色黄)とブロモクレゾールグリーン(酸性色黄、変色域pH3.8~5.4、アルカリ性色青)を2対3の割合で混合したものは、pH5.1で鮮明に変色し、酸性色はぶどう酒赤、アルカリ性色は緑色となる。また、万能指示薬はさらにうまく組み合わせたもので、たとえばチモールブルー、トロペオリンOO、ブロモフェノールブルー、ブロモクレゾールグリーン、ブロモクレゾールパープルの適当量を混合した場合には、pH1.0からpH7.0までの間で、1pH単位ごとに赤、橙(だいだい)、黄、緑、藍(あい)などの色に変化する。
[成澤芳男]
『玉虫文一他編『岩波理化学辞典』第3版増補版(1981・岩波書店)』▽『大木道則他編『化学大辞典』(1989・東京化学同人)』▽『日本化学会編『化学便覧 基礎編』改訂4版(1993・丸善)』▽『日本分析化学会編『定量分析』(1994・朝倉書店)』
改訂新版 世界大百科事典 「指示薬」の意味・わかりやすい解説
指示薬 (しじやく)
indicator
溶液内の化学反応などに関して,当量点のような反応の進行段階を知るために加える試薬。シュウ酸ナトリウムを過マンガン酸カリウムで酸化還元滴定する場合は,当量点で過マンガン酸イオン自身の赤紫色が現れはじめるので,別に指示薬を加えなくとも終点がわかる。しかしこれはむしろ例外であって,一般には反応がどこまで進行したかは外見上わかりにくい。そこで反応に伴う溶液のpHとか酸化還元電位といった適当な物理的性質の変化を装置を用いて測定すればよいのであるが,指示薬の色の変化などから知る方法は比較的簡単でもあり,酸塩基指示薬をはじめ多くの指示薬が古くからよく利用されている。
酸塩基指示薬のp-ニトロフェノールを例にとると,アルカリ性溶液中では黄色の化学種(I⁻と略記)として存在するが,酸性になると水素イオンと結合して無色のHIに変化する。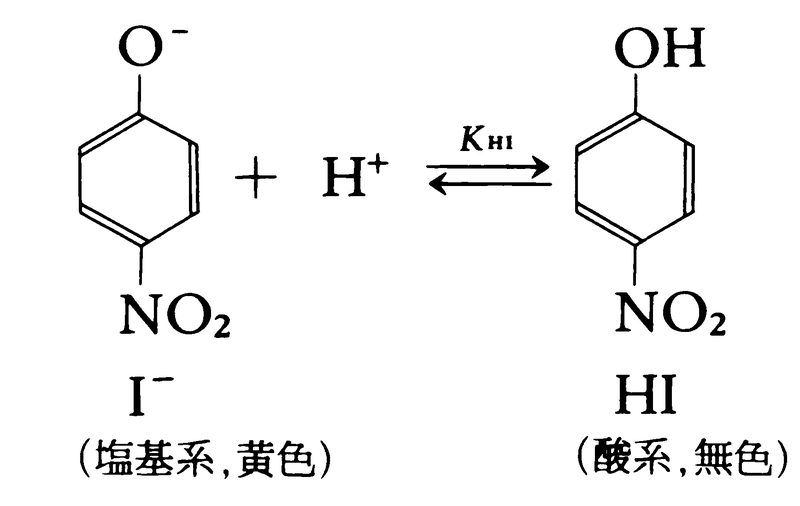
I⁻にH⁺が結合する反応の平衡定数KHIは一定で,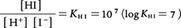 [H⁺]=10⁻7(pH=7)のとき,HIとI⁻の濃度は等しいことがわかる。[H⁺]=10⁻6(pH=6)では[HI]/[I⁻]=10であるから,肉眼ではほとんどHIの色(この例では無色)にしか見えない。逆に[H⁺]=10⁻8(pH=8)では[I⁻]/[HI]=10であるからI⁻の色(例では黄色)に見える。その中間(例ではpH=7)では双方の色が半々ずつ現れる。この点を変色点といい,一般にそのpHはlogK HIに等しい。その前後(約±1pH)では色がしだいに変化するので変色域とよぶ。この例では水素イオン濃度の変化を追跡するために指示薬を使ったのであるが,その際指示薬自身H⁺と反応して変色するわけである。逆に指示薬を加えることによって溶液のH⁺の濃度は多少とも変化することになるので,一般に指示薬の添加量は微量にとどめるべきである。このように酸や塩基の中和を知るために用いるものを酸塩基指示薬という。酸化還元反応においては,それ自身が電子の授受によって変色する酸化還元指示薬を,沈殿滴定においては沈殿に吸着して変化する吸着指示薬adsorption indicatorを用いる。キレート滴定では,金属イオンと結合することにより変色する金属指示薬metal indicatorが用いられる。これは通常それ自身酸塩基指示薬であることが多い。いずれの場合も,微量でも変色がわかるように,染料あるいはその類縁化合物であることが多い。
[H⁺]=10⁻7(pH=7)のとき,HIとI⁻の濃度は等しいことがわかる。[H⁺]=10⁻6(pH=6)では[HI]/[I⁻]=10であるから,肉眼ではほとんどHIの色(この例では無色)にしか見えない。逆に[H⁺]=10⁻8(pH=8)では[I⁻]/[HI]=10であるからI⁻の色(例では黄色)に見える。その中間(例ではpH=7)では双方の色が半々ずつ現れる。この点を変色点といい,一般にそのpHはlogK HIに等しい。その前後(約±1pH)では色がしだいに変化するので変色域とよぶ。この例では水素イオン濃度の変化を追跡するために指示薬を使ったのであるが,その際指示薬自身H⁺と反応して変色するわけである。逆に指示薬を加えることによって溶液のH⁺の濃度は多少とも変化することになるので,一般に指示薬の添加量は微量にとどめるべきである。このように酸や塩基の中和を知るために用いるものを酸塩基指示薬という。酸化還元反応においては,それ自身が電子の授受によって変色する酸化還元指示薬を,沈殿滴定においては沈殿に吸着して変化する吸着指示薬adsorption indicatorを用いる。キレート滴定では,金属イオンと結合することにより変色する金属指示薬metal indicatorが用いられる。これは通常それ自身酸塩基指示薬であることが多い。いずれの場合も,微量でも変色がわかるように,染料あるいはその類縁化合物であることが多い。
ところで中和滴定における指示薬の変色を考えてみると,たとえば赤色から青緑色への変化は肉眼で鋭敏に識別できるが,赤色から黄色への変化はわかりにくい。一般に前者のように互いに補色の関係にある,色調に差のある色の間の変化が最もわかりやすい。このような変化を示す理想的な指示薬はなかなか見つからないが,次のような方法で指示薬を混合することによりかなり解決される。たとえばメチルオレンジやメチルレッドの変色は赤→黄であって単独ではわかりにくい。ところがそこへメチレンブルーを添加すると,これは通常の条件で青色なので,その混合色すなわち赤紫→緑の変色を与えることになる。これは互いに補色に近いので,当量点では薄灰色となりきわめて鋭敏に変色を知り,±0.2pH程度の精度で判別することができる。このような混合指示薬mixed indicatorを遮へい(蔽)指示薬screened indicatorという。狭義の混合指示薬は変色域が似かよっていて,かつあるpHでは互いに補色の関係にあるような色を呈する指示薬を混合したものである。たとえばメチルレッドとブロムクレゾールグリーン(表1参照)を1対1の割合で混合すると,酸性では赤色,pH5.1では無彩色(薄灰色),それよりアルカリ性では緑色を呈するので,精度の高い中和滴定を行うことができる。万能指示薬universal indicatorも一種の混合指示薬であるが,これは数種類の指示薬を混合することにより,広いpH領域にわたって変色できるようにしたものである。たとえばジメチルアミノベンゼン,メチルレッド,ブロムチモールブルー,フェノールフタレイン,チモールフタレインを混合したものはpH2~10の範囲にわたって変色する。単一の指示薬による場合のように明りょうな変色は得られないので,およその値を知る場合にしか用いることができない。これをろ紙にしみ込ませたものが万能pH試験紙である。なお単一の指示薬について,一方の色が無色である場合を単色指示薬または無色指示薬,それ以外のものを複色指示薬または二色指示薬と分類することがある。フェノールフタレインとメチルレッドはそれぞれ前者ならびに後者の例である。
これまでに挙げたものはすべて色の変化を利用したものであるから,まとめて呈色指示薬ということができる。指示薬といえば通常これを意味することが多いが,それ以外にもいろいろなくふうがなされていて,蛍光の発生,消滅あるいは変化によって終点を知ろうとするものが蛍光指示薬fluorescence indicatorである。表4に示したような化合物は酸形と塩基形で異なった色の蛍光を発するので,酸塩基指示薬とまったく同様の原理に基づいて蛍光の変化から中和滴定の終点を知ることができる。一方,塩化物を硝酸銀溶液で滴定するような場合,当量点直後ごくわずかでも過剰に存在する銀イオンAg⁺の効果によって,指示薬として加えたフルオレセインC20H12O5が塩化銀の沈殿に吸着し,それによって沈殿が桃色に変わるので沈殿指示薬precipitation indicatorとして用いられる。またローダミンBやルテニウムの1,10-フェナントロリン錯体は酸化還元電位の変化に伴って蛍光が変化するので,酸化還元滴定に応用されている。金属イオンと結合することによって蛍光を発する金属蛍光指示薬の例としてはモリンC15H10O7や8-ヒドロキシキノリノール(オキシンC9H7NO)がある。それらはガリウム(Ⅲ)イオンGa3⁺と結合しているときは緑色の蛍光を発しているが,終点で蛍光を失う。これは表2に掲げた金属発色指示薬とまったく同様の原理に基づいて考えればよい。一般に蛍光を有する物質はとくに溶液にすると不安定なので保存には適しないが,着色している試料の終点でも見分けられる利点をもっている。ルミノールやルシジェニンのように化学発光(化学ルミネセンス)によって終点を与えるものを化学発光指示薬といい,中和滴定や酸化還元滴定に応用がある。
このほか広義の指示薬としては,物質の挙動を追跡するために加えられる放射性同位体や温度を色の変化で示す化合物が挙げられる。前者を放射性指示薬またはトレーサーといい,後者をサーモカラーとよぶ。リトマスなど液性によって変色する物質の存在は古くから知られていたが,指示薬を最初に系統だって記述したのはR.ボイル(1664)とされている。それを滴定に初めて応用したのはルイスWilliam Lewis(1714-81)であるという説もあるが(1767),ブネルGabriel F.Venel(1723-75)が水を硫酸で分析するときにスミレからの抽出物を用いたという記録が残されている(1750)。酸化還元滴定に初めて指示薬を用いたのはJ.L.ゲイ・リュサックであるといわれている。彼はインジゴが次亜塩素酸によって分解されることを知り,ヒ素(Ⅲ)の次亜塩素酸による滴定に指示薬としてインジゴを用いた(1835)。沈殿滴定に吸着指示薬を導入したのはファヤンスKasimir Fajans(1887-1975)で(1923),彼の名を冠した滴定法(ファヤンス法)は有名である。キレート滴定に金属発色指示薬を初めて導入したのは,やはりこの滴定法の創始者であるシュバルツェンバハGerold Schwarzenbach(1904-78)で,ムレキシドC8H8N6O6をCa2⁺のEDTA滴定に用いた(1946)。
→滴定
執筆者:中須賀 徳行
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「指示薬」の意味・わかりやすい解説
指示薬【しじやく】
→関連項目メチルレッド
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「指示薬」の意味・わかりやすい解説
指示薬
しじやく
indicator
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
化学辞典 第2版 「指示薬」の解説
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
栄養・生化学辞典 「指示薬」の解説
指示薬
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...