翻訳|chlorine
精選版 日本国語大辞典 「塩素」の意味・読み・例文・類語
えん‐そ【塩素】
日本大百科全書(ニッポニカ) 「塩素」の意味・わかりやすい解説
塩素
えんそ
chlorine
周期表第17族に属し、ハロゲン元素の一つ。ハロゲン元素のなかで最初に発見された元素である。
歴史
1774年スウェーデンのシェーレが、塩酸を二酸化マンガンで酸化するとき、黄緑色の気体が発生することをみいだした。1810年イギリスのH・デービーが新元素であることを結論し、ギリシア語で黄緑色を意味するchlorosにちなんで命名した。日本語の塩素は、これが代表的な塩としての塩化ナトリウムNaClの成分であることに基づいている。
[守永健一・中原勝儼]
存在
遊離の状態では存在せず、おもに海水や岩塩中にアルカリ金属およびアルカリ土類金属の塩(NaCl、KCl、MgCl2など)として存在する。天然の同位体組成は35Cl(75.4%)、37Cl(24.6%)である。
[守永健一・中原勝儼]
製法
工業的には、おもに食塩水の電解(隔膜法)によって、また融解塩化物の電解によって製造される。実験室では、塩酸を二酸化マンガンや過マンガン酸カリウムなどの強力な酸化剤で酸化するか、重金属塩化物を熱分解するか、あるいはさらし粉Ca(OCl)Clに塩酸を作用させるなどの方法が行われる。塩素は黄色のボンベに詰めて市販される。
[守永健一・中原勝儼]
性質
常温で黄緑色、刺激臭のある有毒気体で、冷却すると黄色液体を経て黄白色の固体となる。水にかなりよく溶ける。水溶液は0℃に冷却するとクラスレイト化合物(包接化合物)である水和物Cl2・7.7H2Oが得られる。塩素ガスを飽和させた水は塩素水といい、黄緑色の溶液である。漂白作用があり、溶液中には塩酸と次亜塩素酸を生じている。この加水分解反応は冷たい水酸化アルカリ溶液中で100%進む。塩素は化学的に非常に活発で、不活性気体、酸素、窒素、炭素以外のすべての元素単体と直接化合して、塩化物をつくる。水素と混ぜてもそのままでは反応しないが、光、熱、電気火花などで反応が誘導されると、爆発的に反応が進む(連鎖反応)ので、水素と塩素との混合気体を塩素爆鳴気という。いろいろな種類の化合物があり、-Ⅰから+Ⅶまでの酸化数をとるが、おもに奇数の場合が多い。塩素が、より陽性の強い元素と化合した塩化物中では、塩素の酸化数は-Ⅰである。酸化物には、一酸化二塩素Cl2O、二酸化塩素ClO2、六酸化二塩素Cl2O6、七酸化二塩素Cl2O7があるが、いずれも不安定で爆発性がある。オキソ酸には、次亜塩素酸HClO(+Ⅰ)、亜塩素酸HClO2(+Ⅲ)、塩素酸HClO3(+Ⅴ)、過塩素酸HClO4(+Ⅶ)があり、それぞれの塩もある(括弧(かっこ)内は酸化数)。塩化ヨウ素IClのようなハロゲン間化合物なども知られている。
[守永健一・中原勝儼]
用途
水道水や汚水の殺菌および漂白などに多量に用いられるほか、塩酸、さらし粉など多数の無機塩化物や、有機塩素化合物(農薬、医薬、爆発薬、フロン、塩化ビニルなど)の製造原料として広い用途がある。
[守永健一・中原勝儼]
毒性
塩素は第一次世界大戦で毒ガスとして用いられた。
塩素の人体に対する無害の限度は1ppmであるという。空気中に0.003~0.006%存在するだけで粘膜が冒され、鼻炎をおこし、涙、咳(せき)などが出る。長時間吸入すると胸が痛み、血を吐いて呼吸困難となる。塩素濃度の高いところでは、呼吸困難とともにチアノーゼをおこして死に至るので、直接吸わないように注意が必要である。
[守永健一・中原勝儼]
人体に含まれる塩素
塩素の多くは食塩NaClとして摂取される。人体の塩素の90%は、塩素イオンとして、血液、そのほかの体液の成分として存在し、浸透圧の調節や水素イオン濃度指数(pH)の維持にかかわっている。また、一部は、胃酸の構成部分である塩酸として、胃液とともに胃の中に分泌される。胃酸は、タンパク質消化酵素であるペプシンの活性化に必要であり、また、食物中の不用な菌類の殺菌の働きがある。この殺菌によって、腸内での有用細菌の発育を容易にする効果がある。
[河野友美・山口米子]
『IUPAC編、宮本純之監訳『塩素白書』(2000・化学工業日報社)』▽『糸川嘉則編『ミネラルの事典』(2003・朝倉書店)』
塩素(データノート)
えんそでーたのーと
塩素
元素記号 Cl
原子番号 17
原子量 35.453
融点 -100.98℃
沸点 -34.6℃
密度 気体 3.214g/L(0℃,1気圧)
(比重) 液体 1.563(測定温度-34℃)
固体 2.13(測定温度-195℃)
結晶系 斜方
溶解度 0.9972g/100mL(水10℃)
臨界温度 143.5℃
臨界圧 76.0atm(20℃では6.6atm)
元素存在度 宇宙(Si 106個当たりの原子数)
1970(第23位)
地殻 130ppm(第19位)
海水 (/mgL-1)19000
改訂新版 世界大百科事典 「塩素」の意味・わかりやすい解説
塩素 (えんそ)
chlorine
周期表第Ⅶ族に属するハロゲン元素の一つ。ハロゲン元素の中では最も早く単体が分離された元素である。1774年スウェーデンのK.W.シェーレが,塩酸と軟マンガン鉱を反応させてとり出し,〈フロギストンを除いた塩酸〉と報告したのが初めで,その後1810年イギリスのH.デービーによって元素であることが主張された。単体の塩素気体が黄緑色であることから,ギリシア語のchlōros(黄緑色)にちなんで命名された。天然には遊離状態では存在せず,火山ガス中に塩化水素HClとして,海水や岩塩中に塩化物などの形で含まれる。多くの生体中にも含まれ,たとえばヒトの胃酸中にはHClとして存在する。
性質
刺激臭のある黄緑色の有毒気体で,通常二原子分子Cl2から成る。水溶液は塩素水という(後述)。アルカリ水溶液には溶けて,Cl⁻+ClO⁻となる。化学的にはきわめて活発で,希ガス元素を除いてほとんどの元素と化合物をつくる。水素と塩素の1:1混合物は塩素爆鳴気と呼ばれ,光照射などによってエネルギーを吸収すると連鎖反応を起こし,HClを生成して爆発する。炭素,窒素,酸素とは直接反応しない。炭素とアーク放電で,ケイ素とは高温に熱すると反応して塩化物をつくる。ホウ素,リン,ヒ素,アンチモンなどは塩素中で燃えて塩化物をつくる。アルカリ金属および銅,亜鉛,水銀,スズ,ビスマスなどとは光を放って激しく反応し,その他の金属でも多くは常温で,反応しにくいものでも熱すれば反応して塩化物となる。臭化物,ヨウ化物は塩素と反応すると臭素,ヨウ素を遊離して塩化物となる。また,炭化水素と反応させると塩化水素を分離して塩化物をつくるが,メタンCH4やエタンC2H6などの水素の多い炭化水素は,塩素中で燃焼させると爆発的に反応する。また,ろうそくなどは塩素ガス中で燃やすと,成分中の水素のみ燃えて塩化水素となり,炭素を遊離して黒煙をあげる。
製法
実験室における製法にはいろいろの方法があるが,普通は塩酸に酸化マンガン(IV)MnO2,二クロム酸カリウムK2Cr2O7,過マンガン酸カリウムKMnO4などの酸化剤で酸化して得る。
MnO2+4HCl─→MnCl2+2H2O+Cl2
あるいはさらし粉に酸を作用させる。
Ca(ClO)2+4HCl─→CaCl2+2H2O+2Cl2
発生した塩素は水で洗って塩化水素を除き,次いで濃硫酸で水分を除き,五酸化二リンで乾燥する。さらに酸素などを除くには液化させて精製する。
工業的には,古くは電解法のほかに,塩酸を空気酸化する方法その他各種の方法があったが,現在ではもっぱら塩化ナトリウム水溶液の電解によっている。工業用には,乾燥後圧縮,冷却して液体塩素とし,黄色ボンベにつめ,またタンク車で輸送される。
用途
塩化ビニル,塩素系溶剤,合成塩酸,さらし粉をはじめとする次亜塩素酸塩,有機塩素製品(農薬,医薬品,染料,火薬類)などの合成用に大量に消費され,そのほか酸化剤,漂白剤,殺菌剤として,紙・パルプ,上水道などに使われる。
取扱い上の注意
きわめて毒性が強く,そのまま毒ガスとして使われたことがあるほどで,直接吸入してはならない。空気中0.003~0.006‰ですでに粘膜が侵され,鼻炎を起こし,涙,よだれ,咳が出る。長く吸入していると,胸が痛くなり,血を吐き,呼吸困難となる。0.1~1‰では強い呼吸困難を起こし,チアノーゼとなり,ついには死にいたる。
塩素水
水に塩素を通じて溶かし,飽和させると得られる黄緑色の溶液。溶液中には,塩素の一部は分子のまま存在しているが,一部は水と反応して,塩化水素HClと次亜塩素酸HClOを生成している。
Cl2+H2O⇄HCl+HClO
この次亜塩素酸は,熱,光,還元性物質などによって分解して酸素を発生する。
2HClO─→2HCl+O2
この酸素の酸化作用で,漂白,殺菌力が出る。したがって塩素の漂白・殺菌効果は水分の存在下でのほうが高い。
執筆者:中原 勝儼
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「塩素」の解説
塩素
エンソ
chlorine
Cl.原子番号17の元素.電子配置[Ne]3s23p5の周期表17族非金属元素.ハロゲン元素の一つ.原子量35.453(2).安定同位体は35Clと37Clで,天然における存在比はそれぞれ75.76(10)%,24.24(10)% である.1774年スウェーデンのC.W. Scheeleが発見したが,元素であることに気づかず,1810年イギリスのH. Davyが元素と結論し,単体の色(淡緑色)を表すギリシア語χλωρο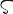 (chl
(chl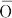 ros)から命名した.
ros)から命名した.
天然には岩塩そのほかの塩化物鉱物として,海水中には塩化物イオンとして存在し,また生体内にも広く分布する.工業的には,食塩水溶液または融解塩化物の電解でつくる.実験室的には,酸化マンガン(Ⅳ)による塩酸の酸化よりつくられる.単体は二原子分子 Cl2.窒息性臭気のある黄緑色の気体.眼やのどを刺激し,有毒である.密度3.214 g dm-3(気体,0 ℃),1.507 g cm-3(液体,-34 ℃),2.03 g cm-3(固体,-100 ℃).融点-101.0 ℃,沸点-33.97 ℃.Cl-Cl0.198 nm.臨界温度143.81 ℃.臨界圧7.991 MPa.臨界密度0.5727 g cm-3.溶解度0.9972 g/100 g 水(10 ℃),15.6 g/100 g 四塩化炭素(0 ℃),25 g/100 g クロロホルム(10 ℃).水に溶解すると塩素は可逆的に反応し,次亜塩素酸と塩酸を生じる.塩素水を0 ℃ にするとCl2・nH2O(n = 6~8)の包接化合物が得られる.フッ素,酸素についで電気的に陰性な元素で,第一イオン化エネルギー1251.1 kJ mol-1(12.967 eV).通常,酸化数-1,0,1,3,5,7で化合物をつくる(例:HCl,Cl2,HClO,HClO2,HClO3,HClO4).Cl-1 のイオン半径0.181 nm.反応性に富み,希ガス元素,炭素,酸素,窒素を除くほかの元素と直接化合物をつくる.水素とは光などのエネルギーにより爆発的に化合し,塩化水素をつくる([別用語参照]塩素爆鳴気).多くの金属の臭化物やヨウ化物は塩素との反応により塩化物となり,それぞれ臭素やヨウ素を遊離する(例:2Br- + Cl2 → Br2 + 2Cl-).ほかのハロゲンとハロゲン相互間の化合物(ClF,BrCl,IClなど)をつくる.金属や非金属との反応では塩化物やオキシ塩化物を生成する.乾燥した塩素はFeやPbを侵さないので,加圧液化して鉄製ボンベに詰めて市販される.工業的に非常に重要な元素で,酸化剤,漂白剤,殺虫剤,塩化物および有機塩素化合物など多くの化合物の原料に用いられ,ハロゲン族元素のなかではもっとも用途の広いものである.毒劇物取締法劇物,大気汚染防止法特定物質,労働安全衛生法特定化学物質などの指定をうけている.水道法水質基準値残留塩素1 mg/L 以下.[CAS 7782-50-5][別用語参照]液体塩素
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「塩素」の意味・わかりやすい解説
塩素
えんそ
chlorine
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「塩素」の意味・わかりやすい解説
塩素【えんそ】
→関連項目トリハロメタン|有機塩素化合物
出典 株式会社平凡社百科事典マイペディアについて 情報
漢方薬・生薬・栄養成分がわかる事典 「塩素」の解説
えんそ【塩素】
栄養・生化学辞典 「塩素」の解説
塩素
世界大百科事典(旧版)内の塩素の言及
【殺菌剤】より
…一つは環境や器具器材などが汚染されたときに使用するもので,他は創傷などに際して感染を防ぐために用いられる殺菌剤である。前者のものとしては塩素や塩素化合物,石炭酸(フェノール),ヨウ素化合物が代表的であり,後者にはヨードチンキなどヨウ素化合物,アルコールが代表的であるが,両者に共通して用いられるものも少なくない。(1)塩素および塩素化合物 殺菌剤の発展は微生物学の進歩を語らずには成り立たない。…
※「塩素」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...



