内科学 第10版 「遺伝子不整脈」の解説
遺伝子不整脈(循環器疾患と遺伝子異常)
(1)先天性QT延長症候群
定義・概念
先天性QT延長症候群は,QT時間の延長(図5-4-1A)とtorsade de pointes(TdP)とよばれる多形性VTを認め,失神や突然死を引き起こす症候群である(図5-4-1B)(Shimizu,2008;Shimizu,2011).
疫学
頻度は5000人に1人とされているが,遺伝子変異を有していてもQT延長やTdPを発症しない非浸透患者を認め,実際の頻度はさらに高いと考えられる.明らかな性差はない.
分類・病因・病態生理(分子病態)
臨床的に,常染色体優性遺伝形式をとるRomano-Ward症候群と,常染色体劣性遺伝形式をとり両側性感音性難聴を伴うJervell-Lange-Nielsen症候群に分類される.50〜70%の患者でK+,Na+,Ca2+電流などのイオンチャネルに関連する遺伝子上に変異を認め,心室筋活動電位プラトー相の外向きK+電流が減少,または内向きNa+,Ca2+電流が増加して心室筋活動電位持続時間(APD)が延長しQT時間が延長する.Romano-Ward症候群では,遺伝子診断により8つの染色体上に13個の遺伝子型が報告され(Shimizu,2008;Shimizu,2011) (表5-4-4),保険診療も承認されている.各遺伝子型の頻度は,LQT1が40%,LQT2が40%,LQT3が10%で,この3つで90%以上を占める.Jervell&Lange-Nielsen症候群では2つの遺伝子型が報告され,KCNQ1またはKCNE1のホモ接合体であるため重症のQT延長に難聴を伴う(表5-4-4).
診断
臨床診断はSchwartzの診断基準が用いられ,心電図所見(QT時間,TdP,交代性T波,ノッチT波,徐脈),臨床症状(失神発作,先天性聾),家族歴を点数化し,その合計点数が4点以上で診断確実,2または3点は疑い,1点以下は可能性が低いと判定する.
鑑別診断
失神をきたすすべての疾患,および薬剤,電解質異常,徐脈などの誘因とする後天性(二次性)
QT延長症候群を鑑別する必要がある.
臨床症状
症状は失神,心停止,突然死であり,頻度の多いLQT1,LQT2,LQT3では,遺伝子型により臨床症状や予後が異なる(Shimizu,2008;Shimizu,2011). LQT1では,症状の多くは運動中に起こり,特に水泳中に多い.LQT2の症状の多くは情動ストレス(恐怖や驚愕),音刺激(目覚まし時計など)による覚醒時など,急激に交感神経が緊張する状態で起こる.LQT3では,睡眠中や安静時に心事故が多い.
経過・予後
LQT1,LQT2の生涯心事故発生率はLQT3に比べ高いが,致死的心事故発生率はLQT3で高い.
生活指導・治療
遺伝子型特異的治療が実践されている(Shimizu, 2008;Shimizu,2011).
LQT1では,運動制限が必須であり,体育系クラブや競争的スポーツ(マラソン,リレー競技,全力疾走),競泳,潜水などは禁止する.薬物治療としては,β遮断薬が特に有効である.LQT2でも,運動制限とβ遮断薬が有効であるが,LQT1に比べて有効性はやや低い.K+製剤とK+保持性利尿薬の併用による血清K+値の上昇も有効である.LQT3では,メキシレチンが有効である.いずれの遺伝子型でも,VFまたは心停止既往例では植え込み型除細動器(ICD)のクラスI(絶対)適応である.LQT3ではペースメーカ治療も有効である.
(2)Brugada症候群
定義・概念
Brugada症候群は,12誘導心電図のV1からV2(V3)誘導でST上昇を認め,おもに夜間睡眠中または安静時にVF
を発症し突然死の原因となる疾患である(Antzelevitchら, 2005;Shimizu,2008).
疫学
VFの初発年齢は40〜50歳代で,男性に多く(男女比8:1~9:1),日本を含めたアジア地域で頻度が高い.Brugada型心電図(coved型またはsaddle back型)の頻度は一般健常人の0.05〜0.1%とされている.
分類・病因・病態生理(分子病態)
外的因子や一部遺伝子変異により,一過性外向き電流(Ito)などの外向きK+電流が増加,またはNa+電流,Ca2+電流などの内向き電流が減少すると,右室流出路の心外膜-心内膜細胞間で活動電位第1相に電位勾配が生じ,J波およびこれに引き続くST部分が上昇する.また,近接する心外膜細胞間で大きな再分極時間のバラツキが生じ,phase 2 reentryを機序としてVFの引き金となる心室期外収縮が出現する.VFが持続するには軽度の脱分極(伝導)異常が必要と考えられている.遺伝子診断では,7つの遺伝子型が報告されているが(Shimizu,2008;Shimizu,2011)(表5-4-4),遺伝子変異が同定されるのは約30%である.
診断
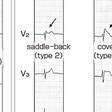
診断確定には,安静時またはNa+チャネル遮断薬投与後に,J点またはST部分が基線から0.2 mV以上上昇するtype 1のcoved型ST上昇を認めることが必須条件である(図5-4-2A,B).また,高位肋間記録(V1,V2が第3または2肋間)のみでtype 1 ST上昇を認める場合も,Brugada心電図と考える(図5-4-2C).type 1心電図に加え,(1)VFの確認,(2)自然停止する多形性VT,(3)突然死(45歳以下)の家族歴,(4)coved型ST上昇の家族歴,(5)電気生理学的検査でのVF誘発,(6)失神発作,または(7)夜間苦悶様呼吸のうち1つ以上を認める場合にBrugada症候群と診断される.
鑑別診断
急性心筋梗塞(特に右室梗塞),急性心筋炎,解離性大動脈瘤,急性肺塞栓症,不整脈源性右室心筋症を鑑別診断する必要がある.
臨床症状
失神,心停止,突然死として発症する.
経過・予後
厚生労働省研究報告では,VF既往のあるBrugada患者の年間VF再発率は10.7%と高いが,無症状のBrugada患者の新規年間VF発生率は0.4%と低く,失神既往のある患者でも0.7%と欧州の報告に比べ低い.
治療
VF,心停止既往例では,ICDのクラスⅠ適応である.薬物療法はICD植え込み後の補助的治療であり,キニジンの有効性が報告されている.VF急性期にはイソプロテレノールの持続点滴が有効である.
(3)カテコールアミン誘発性多形性心室頻拍
定義・概念
カテコールアミン誘発性多形性心室頻拍(catecholaminergic polymorphic VT:CPVT)は,交感神経緊張時に,特徴的な二方向性VTや多形性VTが出現し,VF
に移行して小児期の突然死の原因となる疾患である.
疫学
小児期から発症することが多く,性差はない.
病因・病態生理(分子病態)
筋小胞体(SR)のリアノジン受容体遺伝子であるRYR2と,カルセクエストリン2遺伝子(CASQ2)の変異が報告されている(表5-4-4).
診断・鑑別診断
運動中の特徴的な二方向性VTや多形性VTから診断は比較的容易であるが,LQT7型のAndersen-Tawil症候群との鑑別が必要である.
臨床症状
失神,心停止,突然死として発症する.
治療
β遮断薬,およびCa2+拮抗薬との併用が有効であるが,RYR2変異陽性例でNa+チャネル遮断薬のフレカイニドが有効である.VF
や心肺停止既往例ではICDの適応である.
(4)QT短縮症候群
QT短縮症候群(short QT syndrome:SQTS)は,QT時間の短縮とVFや心房細動(
AF)を認める症候群である.
疫学
頻度は少なく,性差はない.
病因・病態生理(分子病態)
5つの遺伝子型が報告されており,SQT1,SQT2,SQT3では,遺伝子変異によりK+
電流の増強をきたしQT時間が短縮する.SQT4,SQT5は,Brugada症候群との合併例である.
診断
QT時間で280~300 msec以下,修正QT(QTc)時間で300~320 msec以下の短縮に加えてVFや失神を認める場合に診断される.
臨床症状
失神,心停止,突然死として発症する.
治療
VFや心停止既往例ではICDが必須治療である.薬物治療はICDの補助的治療であり,SQT1ではキニジンの有効性が報告されている.
(5)早期再分極症候群
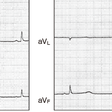
早期再分極症候群(early repolarization syndrome:ERS)は,器質的心疾患を認めない特発性心室細動(IVF)の中で,12誘導心電図の下壁(Ⅱ,Ⅲ,aVF)または前側壁(I,aVL,V4-V6)誘導でJ波または早期再分極を認める新しい疾患概念である.
疫学
頻度は不明であるが,男性に多い.
病因・病態生理(分子病態)
一部の患者では,遺伝子診断により,ATP感受性K+電流(IK-ATP)の機能に関係するKCNJ8,CACNA1C,CACNB2b,CACNA2D1などのL型Ca2+チャネル遺伝子,SCN5Aに変異が報告され,変異によりIK-ATPの増加,Ca2+電流またはNa+
電流の減少がJ波の成因とされている.
診断
Brugada症候群を除外した狭義のIVFのなかで,12誘導心電図の左室下壁(Ⅱ,Ⅲ,aVF)あるいは前側壁(I,aVL,V4-V6)誘導の2誘導以上で0.1 mV
以上のJ波または早期再分極を認めれば診断される.
臨床症状
失神,心停止,突然死として発症する.
治療
VF既往例ではICDのクラスI適応となる.Brugada症候群と同様にイソプロテレノールやキニジンが有効である.[清水 渉]
■文献
Antzelevitch C, Brugada P, et al: Brugada syndrome. Report of the Second Consensus Conference. Endorsed by the Heart Rhythm Society and the European Heart Rhythm Association. Circulation, 111: 659-670, 2005.
Shimizu W: Clinical impact of genetic studies in lethal inherited cardiac arrhythmias. Circ J, 72: 1926-1936, 2008.
Shimizu W, Horie M: Phenotypical manifestations of mutations in genes encoding subunits of cardiac potassium channels. Circ Res, 109: 97-109, 2011.
出典 内科学 第10版内科学 第10版について 情報