内科学 第10版 「B型慢性肝炎」の解説
B型慢性肝炎(ウイルス性慢性肝炎)
定義・概念
B型慢性肝炎は,臨床的には「6ヶ月以上の肝機能検査値の異常とB型肝炎ウイルス(HBV)感染が持続している病態」として定義される.組織学的には,慢性肝炎は国際的に,線維化と炎症の程度により分類される.わが国でも新犬山分類の肝組織診断基準に基づき,線維化と壊死・炎症の程度により分類される.
病因
B型慢性肝炎の病因は,HBVの持続感染である.わが国のHBVの持続感染の多くは,出生時に母親から感染する母子感染(垂直感染)であり,残りが3歳以下での水平感染であると推測されている.免疫能が未発達な新生児・乳幼児期の急性感染では,HBVを排除できずにキャリア化することが多い.一方,免疫能が発達した思春期以降の急性感染では,多くの場合一過性感染であり持続感染化することは少ない.しかし,都市部で特に異人種間の同性間性交渉により広がっている遺伝子型Aの急性感染では,約10%が持続感染化(慢性化)するとされている.また,免疫抑制療法あるいは化学療法により一過性感染者の肝細胞内にわずかに潜伏しているHBVが再活性化し,肝炎を生ずる症例も存在するので注意する必要がある.
疫学
HBV保有者(キャリア)の数は,世界中に約3億5千万人,日本中に130万~150万人いると推定されており,わが国の慢性肝疾患の約20%,肝細胞癌の約15%がHBV感染によるものとみなされている.
HBV 遺伝子型(genotype)や亜型(subgenotype)の違いにより,ウイルス学的特徴だけでなく,B型肝炎の病態や治療効果が異なることが明らかにされている.世界各国で分離同定されたHBV遺伝子型は,現在のところA~Jの9型(IはCの亜型)とされており,系統樹解析により遺伝子型Aは欧米型 (Ae)とアジア・アフリカ型 (Aa),遺伝子型Bはアジア型 (Ba)と日本型(Bj)に亜型分類される.わが国における遺伝子型の割合は(Oritoら,2001),遺伝子型Aが1.7%,遺伝子型Bが12.2%,遺伝子型Cが84.7%,遺伝子型Dが0.4%,混合型が1.0%と遺伝子型Cが多くを占めている.地域分布でみると,沖縄と東北地方に遺伝子型Bが多く,それ以外の地域に遺伝子型Cが多いという地域特異性が存在する.
病理
組織学的には,門脈域にリンパ球を主体とした細胞浸潤と線維化を認め,肝実質内には種々の程度の肝細胞の変性・壊死所見を認める.新犬山分類は,その組織所見を反映させ,線維化(ステージ)と活動性(グレード)の各段階に分けて表記することとしている.
線維化の程度は,門脈域より線維化が進展し小葉が改築され,肝硬変へ進展する段階を線維化なし(F0),門脈域の線維性拡大(F1),bridging fibrosis(線維性架橋形成)(F2),小葉のひずみを伴うbridging fibrosis(F3)までの4段階に区分される.さらに結節形成傾向が全体的に認められる場合は,肝硬変(F4)と分類される.壊死・炎症所見は,その程度により活動性なし(A0),軽度活動性(A1),中等度活動性(A2),高度活動性(A3)の4段階に区分される.活動性の評価は,piecemeal necrosis,小葉内の細胞浸潤と肝細胞の変性・壊死(spotty necrosis,bridging necrosisなど)で行う. B型慢性肝炎とC型慢性肝炎の組織像を比較すると,B型ではC型に比較して小葉内の好酸体や小壊死巣が多く,piecemeal necrosisを認める例が多く,炎症の活動性が強い.
病態生理
HBVによる持続的な肝細胞障害の機序には,HBV感染肝細胞に対する細胞障害性Tリンパ球(CTL)を中心とした宿主の免疫応答の関与が考えられている.肝細胞表面にヒト白血球抗原(human leukocyte antigen:HLA)分子によって抗原提示されたHBs蛋白,core蛋白,ポリメラーゼ蛋白などが,CTLの認識するエピトープとして報告されている.しかし,B型急性肝炎と比較して,B型慢性肝炎ではウイルス排除に働く抗原特異的免疫応答は弱く,そのことがHBVの持続感染化と関連していると考えられている.
臨床症状
1)自覚症状:
多くは自覚症状を認めない.慢性肝炎の経過中または無症候性キャリアの状態から「急性増悪」とよばれる一過性の強い肝障害を生じた場合には,全身倦怠感,食欲不振,褐色尿,黄疸などの症状が認められることがある.
2)他覚症状:
慢性肝炎の進展に伴い,肝臓の軽度腫大が認められる.肝硬変に近づくにつれて,脾腫,くも状血管腫,手掌紅斑などの症状が認められることがある.
検査成績
生化学検査では,トランスアミナーゼ(AST,ALT)が,肝細胞障害により上昇する.慢性肝炎ではALT優位の上昇であるが,肝硬変へ進行するにつれてAST優位の上昇に移行する.LDHも肝細胞障害により上昇するが,変動の程度は低い.ALPやγ-GTPは,胆汁うっ滞の程度に応じて上昇する.総ビリルビンは直接(抱合)ビリルビンと間接(非抱合)ビリルビンからなるが,慢性肝炎の進行に伴い間接ビリルビン優位の上昇がみられる.膠質反応(ZTT)はアルブミンの減少および免疫グロブリンの増加により上昇するため,慢性肝炎の発見に有用である.アルブミンは,慢性肝炎の進行に伴い減少するため経過観察に有用であるが,栄養障害,ネフローゼ症候群などでも減少するため,鑑別が必要である.ガンマグロブリンは,慢性肝障害に伴い上昇し,慢性肝炎から肝硬変への進行の指標になる.肝線維化マーカーであるⅢ型プロコラーゲンペプチド(PⅢP),Ⅳ型コラーゲン,ヒアルロン酸も肝線維化の程度を反映しており,肝硬変での著明な上昇がみられるため,慢性肝炎との鑑別に有用である.血液学的検査では,血小板数が肝病態(肝線維化)の進行に伴い減少する. 腹部超音波検査では,一般的に肝辺縁の鈍化,肝実質の軽度粗~不均一,肝の大きさの正常~やや腫大が認められ,肝線維化の進行に伴い,右葉の萎縮,左葉の腫大,肝実質の不均一~結節状,脾腫がみられるようになる.
診断
B型慢性肝炎の診断には,各種HBVマーカーの測定が必要である(表9-4-1).HBs抗原(通常HBc抗体高抗体価陽性)陽性で,HBVの増殖(血中HBV DNAが陽性)を伴うALT値の異常が6カ月以上持続すればB型慢性肝炎と診断される.HBe抗原陽性ではHBV DNA 量は高値を示し,肝炎が活動性で感染性が強い.HBe抗原陰性およびHBe抗体陽性ではHBV DNA量が低値を示す場合が多く,一般に肝炎が非活動性であり感染性も弱い.肝生検による組織所見で,F2/A2以上は活動性の慢性肝炎,F4は肝硬変と診断される.
自然経過
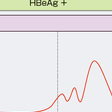
B型慢性肝炎の自然経過は,①HBe抗原陽性無症候性キャリア期,②肝炎期,③HBe抗体陽性非活動性キャリア期,④再活性期に分類される(図9-4-1).
1)HBe抗原陽性無症候性キャリア期:
HBe抗原陽性で血中HBV DNA量も高値であるが,トランスアミナーゼが正常であり,自覚および他覚症状は乏しい.HBVに対する免疫寛容の状態(HBV感染肝細胞に対する宿主の免疫応答がない)であるため,HBV DNA量が多いにもかかわらず,肝組織像で炎症・線維化所見はほとんどみられない.
2)肝炎期:
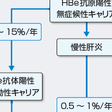
思春期頃になると,免疫能の発達に伴いHBVに対する免疫寛容状態が解除され始め,感染肝細胞に対するCTLの宿主免疫応答による肝細胞障害が起こり,肝炎を発症してトランスアミナーゼが上昇する.この時期が長期でトランスアミナーゼの高値が持続した症例では,肝線維化が進行し,軽度の慢性肝炎から肝硬変へと進展する.このウイルス排除反応に伴い,血中HBV DNA量は次第に減少し,肝炎は沈静化に向かう.肝炎による肝細胞障害の後にHBe抗原陽性からHBe抗体陽性に移行する,いわゆるセロコンバージョンが認められる.セロコンバージョンは年率8~15%程度で生じ,自然経過では成人期までに約85〜90%で認められる.残りの約10~15%のうち,多くは肝炎が持続し1~5%/年の割合で肝硬変へと進展する(図9-4-2).肝組織像では,セロコンバージョンを生じ,肝炎が沈静化した場合には軽度の炎症・線維化所見がみられるのみであるが,セロコンバージョンを生ずるまで肝炎が長期間持続する場合には,炎症・線維化所見は高度となる.
3)HBe抗体陽性非活動性キャリア期:
HBV感染肝細胞と宿主の免疫反応に終止符が打たれ,肝炎が沈静化している安定期である.セロコンバージョンが持続し,トランスアミナーゼが持続正常を示すこの時期では,HBVの増殖が著しく低下するため,HBV DNA量はPCR法で検出が可能な程度(4log copies/mL未満)に減少する.肝組織像では,炎症所見は改善するが,線維化所見は肝炎期の炎症の程度や期間によって決定される.この時期を経てHBs抗原が消失し,HBs抗体が出現して,いわゆる“臨床的治癒”に到達するHBVキャリアは約1~2.5%/年程度である.
4)再活性期:
HBe抗原のセロコンバージョン後,トランスアミナーゼが長期間正常を持続していても再活性化(HBV DNA量の増加,ALT値の上昇,HBe抗原の再出現)する症例が存在する.再活性化した症例では,肝炎の程度はさまざまであるが,ときに重症化することがある.再活性化のリスクは,免疫抑制療法あるいは化学療法の際により高くなる.また,HBs抗原が消失し,HBs抗体が出現して,いわゆる“臨床的治癒”に到達したHBVキャリアにおいても,肝臓内や末梢血単核球で低レベルのHBV産生が持続しており,ウイルス学的には持続感染の状態であるとみなされる.したがって,このような既往感染症例において,免疫抑制療法あるいは化学療法を使用中あるいは使用後にHBVの再活性化が生じることがある.再活性化のリスクは,免疫抑制の程度が強くなるにつれて高くなるが,悪性リンパ腫に対するリツキシマブとステロイドを含む治療において,リスクがより高いことが明らかにされている.
予後・合併症
HBV遺伝子型と病態との関連において,遺伝子型Cは遺伝子型Bに比べ,HBe抗原陽性率が高く,HBe抗原陽性からHBe抗体陽性へと移行するセロコンバージョン率が低い傾向がある(表9-4-2).したがって,遺伝子型CのB型慢性肝炎は遺伝子型Bに比べ,肝病態の進行が速く,肝硬変や肝細胞癌を早期に発症し,予後不良である.
慢性肝炎から肝硬変に進展した場合,予後を規定するのは,肝不全,食道静脈瘤の治療,肝細胞癌の早期診断,早期治療である.特に,肝硬変からは3%/年の割合で肝細胞癌が発生する(図9-4-2).しかし,B型慢性肝炎では,HBV遺伝子の宿主肝細胞のDNAへの組み込みなどにより,必ずしも肝硬変に至らずに肝細胞癌を生じることがあるため注意する必要がある.
治療
1)治療の目標:
慢性B型肝炎では,肝細胞内のHBVの完全な排除が難しいため,HBVの増殖を持続的に抑制することにより肝炎を鎮静化させて,肝線維化の進行,肝硬変や肝細胞癌への進展を防ぐことが重要である.したがって,治療の目標は,①HBe抗原陽性からHBe抗体陽性へのセロコンバージョン,②血中HBV DNA(PCR法)の持続的な陰性化,③ALT値の持続的な正常化であり,最終的に④HBs抗原陽性からHBs抗体陽性へのセロコンバージョンを達成することである.
2)抗ウイルス療法:
抗ウイルス療法としてインターフェロン(IFN)と核酸アナログ製剤がおもに使用される.IFNは,抗ウイルス作用,免疫調節作用,細胞増殖抑制作用など種々の生物活性を有する薬剤で,わが国では,IFN治療の投与期間は原則24週間であるが,2011年に承認されたペグインターフェロン(Peg IFN)αでは48週間の長期投与が標準である.IFN療法は,原則として,HBe抗原陽性の35歳未満の若年者が対象となる.しかし,血小板数が15万未満または肝組織がF2以上の線維化進行例には,最初から核酸アナログ製剤による治療を行う.核酸アナログ製剤は,HBe抗原陽性・陰性にかかわらず,HBVの増殖を伴い,肝機能異常を伴うB型慢性肝炎および肝硬変が適応である.原則として,35歳以上ではIFNによる治療効果が得られ難いため,核酸アナログ製剤による治療を選択する.
現在わが国で使用可能な核酸アナログ製剤には,HBVの逆転写酵素を阻害することにより強い抗ウイルス効果を示すラミブジン,アデホビル,エンテカビルがある.核酸アナログ製剤未治療例に対する第一選択として推奨されるのは,耐性株の出現頻度が最も低いエンテカビルである.ラミブジン治療では,投与開始5~6カ月以降から耐性株が高率に出現しHBVが再増殖して肝炎が再燃することから,厚生労働省研究班によるガイドラインは(熊田,2010),ラミブジン治療中の症例では投与期間にかかわらずHBV DNA 量が2.1log copies/mL未満を持続している場合,原則エンテカビルへの切り替えを推奨している.アデホビルは,単独投与で耐性株の出現頻度が比較的高いことから,ラミブジンとの併用投与が基本とされており,ラミブジンおよびエンテカビル耐性株に対する治療として推奨されている.
3)肝庇護療法:
IFNや核酸アナログ製剤による抗ウイルス療法で十分な治療効果が得られなかった症例,抗ウイルス療法の投与が難しい症例(高齢者,妊娠希望女性)などでは,強力ネオミノファーゲンC(SNMC),ウルソデオキシコール酸(UDCA)などの肝庇護薬で経過をみることも可能である.[大石和佳・茶山一彰]
■文献
茶山一彰,大石和佳,他:慢性肝炎治療薬の選び方と使い方,pp1-137,南江堂,東京,2005.熊田博光:厚生労働科学研究費補助金肝炎等克服緊急対策研究事業(肝炎分野),肝硬変を含めたウイルス性肝疾患の治療の標準化に関する研究,平成21年度総括・分担研究報告書,2010.
Orito E, Ichida T, et al: Geographic distribution of hepatitis B virus (HBV) genotype in patients with chronic HBV infection in Japan. Hepatology, 34: 590-594, 2001.
出典 内科学 第10版内科学 第10版について 情報