内科学 第10版 「癌遺伝子・癌抑制遺伝子」の解説
癌遺伝子・癌抑制遺伝子(腫瘍)
(1)癌遺伝子
癌遺伝子は,元来ニワトリやネズミに癌を引き起こすレトロウイルスのゲノム中に組み込まれ,ニワトリやマウスの細胞を癌化(悪性形質転換)させる遺伝子(v-oncogene)として発見された(RousのRous肉腫ウイルス,1911年).その後の研究で,これらのv-oncogeneがもともとはニワトリやマウスの細胞のもつ正常の遺伝子(プロト癌遺伝子)に由来し,ウイルスの進化の過程でウイルスゲノムに取り込まれたこれらのプロト癌遺伝子が,変異や部分的欠損により活性化されたものであることがわかった.ヒトの癌細胞でも,ウイルス感染とは関係なく,何らかの要因によりこれらのプロト癌遺伝子に変異や増幅,遺伝子の再編成などが起きることにより,v-oncogeneと同様に機能的に活性化された活性型癌遺伝子の存在が見いだされた.現在では,細胞がもっている遺伝子が何らかの機構で活性化され,細胞を癌化させるようになった遺伝子群を総称して癌遺伝子とよんでいる.
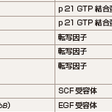
癌遺伝子として最初に確定したのは,先に述べた1976年のRous肉腫ウイルス由来のv-src遺伝子である.1982年にはWigler,Weinberg,Barbacidらによって癌遺伝子H-rasが同定された.同定されたH-ras遺伝子は蛋白質をコードする塩基配列内の1カ所の点突然変異によりアミノ酸配列が変わることによりras蛋白質が活性化することがわかった.活性型H-ras遺伝子の発見以来,癌遺伝子研究は急速に進み,これまでに細胞増殖因子,増殖因子受容体,細胞内シグナル伝達因子,核内蛋白質などの機能を有し,ヒト癌の発症に関与する癌遺伝子として100種類以上のものが同定されている.
最近,薬物代謝(解毒)や酸化ストレス応答にかかわる遺伝子として知られていたNRF2遺伝子が,新たなタイプの癌遺伝子として発見された(Singh A,et al., 2006).NRF2遺伝子の癌における活性化変異の頻度は,臓器により多少の差違はみられるものの,おおむね10%をこえるとされている.NRF2蛋白質は癌細胞の増殖を亢進させる遺伝子の転写を誘導することが知られている.NRF2蛋白質の核内移行が増加した癌細胞は,抗癌薬や酸化ストレスに対して抵抗性を示し細胞増殖能も高いことから,NRF2蛋白質は新たな治療標的としても注目されている.
正常細胞のプロト癌遺伝子が活性化される分子機構としては,点突然変異(point mutation),遺伝子増幅(amplification),染色体転座(chromosomal translocation)などがある.点突然変異の例としては,種々の癌におけるK-,N-,H-ras遺伝子,甲状腺癌におけるRET遺伝子,大腸癌や悪性黒色腫におけるβ-catenin遺伝子,非小細胞肺癌などにおけるNRF2遺伝子がある.活性化遺伝子増幅の例としては,神経芽腫,小細胞肺癌におけるN-myc遺伝子,肺癌におけるEGFR/ErbB遺伝子,乳癌におけるNEU/ErbB2遺伝子があげられる.染色体転座の例としては,Burkittリンパ腫におけるc-myc遺伝子と免疫グロブリン長鎖のエンハンサー領域との遺伝子再編成,慢性骨髄性白血病での9番染色体と22染色体の転座[Philadelphia(Ph1)染色体,t(9;22)]によるBCR-ABLキメラ遺伝子,急性前骨髄球性白血病におけるPML-RAR-α遺伝子,急性骨髄性白血病における8番染色体と21番染色体の転座によるAML1-MTG8遺伝子,小児の急性リンパ性白血病のTEL-AML1遺伝子などがあげられる.代表的な癌遺伝子およびその機能について表1-4-2にまとめた.
最近,血液癌以外の固形腫瘍においても,染色体転座によるさまざまな融合遺伝子が発見された.Ewing肉腫などの骨軟部腫瘍では融合遺伝子の存在がすでに知られていたが,通常の上皮系腫瘍においても活性化された融合遺伝子が見いだされてきた.肺腺癌の3〜5%に存在するEML4-ALK融合遺伝子の発見(間野ら,2007)は,シークエンス技術の革新的進歩による大規模ゲノム解読の成果としてもたらされたものである.その後,肺腺癌の2%程度に存在するKIF5B-RET,CD74/SLC34A2/EZR-ROS1,乳癌の3%程度に存在するMAGI3-AKT3,グリオーマの3%程度に存在するFGFR3-TACC3などの遺伝子融合が次々と発見された.固形癌におけるこれら融合遺伝子の発見は,固形癌に対する新しい治療法開発の活路となることが期待されている.
癌遺伝子のコードする蛋白質の本来の機能としては,細胞増殖や細胞周期,あるいは細胞死の制御にかかわるものが多く,これらの機能亢進(活性化)により細胞の増殖能や浸潤能・運動能が亢進し,あるいは細胞死に対する抵抗性を賦与していると考えられる.
(2)癌抑制遺伝子
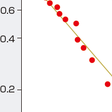
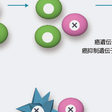
癌抑制遺伝子は父親および母親由来の相同染色体上の対立遺伝子がともに欠失あるいは機能喪失し,遺伝子本来の機能を欠損することにより細胞を癌化に至らしめる遺伝子のことである.遺伝性癌の場合には,すでに片側の対立遺伝子の異常(多くの場合は点突然変異)を親から遺伝的に受け継いでいる.さらにもう片方の対立遺伝子の異常(染色体欠失,遺伝子再編成,点突然変異など)が加わることにより,癌抑制遺伝子の癌抑制効果が失われ細胞は癌化する.癌抑制遺伝子の発見の契機となったのは小児の網膜芽細胞腫の研究である.Knudsonは,網膜芽細胞腫発症は2回の突然変異で起こるという仮説「two-hit理論」を1971年に提唱した(図1-4-4).その後1983年に,WhiteとCaveneeにより網膜芽細胞腫においてヒト13番染色体にある対立遺伝子の片方が消失していることが証明され,1986年に網膜芽細胞腫の癌抑制遺伝子としてRB遺伝子が同定された.遺伝性の網膜芽細胞腫では変異型のRB遺伝子を遺伝的に親から引き継いでいるため,もう片方の対立遺伝子へのsecond hitが月齢に対して直線的に増えてくると,網膜芽細胞腫の発症も直線的に増えてくる.一方,非遺伝性の網膜芽細胞腫では,原因遺伝子であるRB遺伝子の両側の対立遺伝子に計2回のhitが必要なために,早い月齢での発症数が少なく発症年齢の遅れが生じることになるわけである.RB遺伝子の発見に引き続き,その後も遺伝性癌の分子遺伝学的な解析から,種々の癌抑制遺伝子が続々と発見された.家族性大腸腺腫症の原因遺伝子であるAPC遺伝子,Wilms腫瘍のWT1遺伝子など,現在までに50種類以上の癌抑制遺伝子が単離されている(表1-4-3).また,癌抑制遺伝子の多くのものは特定の臓器の癌種で異常を認めることが多いが,なかにはp53遺伝子やp16遺伝子,PTEN遺伝子のように多くの癌で共通に異常が認められるものがある.特にp53遺伝子の異常は全癌の50%以上に認められ,細胞の癌化にとってきわめて重要な役割を果たしていることがわかる.
これらの癌抑制遺伝子の機能に関しては,たとえば,RB遺伝子は細胞周期の制御や転写に関与しており,APC遺伝子はWNTシグナルを介する転写制御,TSC1/TSC2遺伝子はmTORを介する翻訳制御,p14/p16遺伝子は細胞周期制御など,その機能は多岐にわたっている.なかでもp53遺伝子は,転写,細胞周期,DNA損傷修復,細胞死(アポートシス)の制御など,1つの遺伝子産物が複数の細胞内機能を担っていることがわかってきた.
(3)癌抑制遺伝子の不活化機構
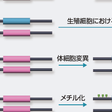
癌抑制遺伝子の場合には,癌遺伝子と異なり両方の対立遺伝子がともに不活化される.不活化にはいくつかの機構が考えられる(図1-4-5).すなわち,①古典的なKnudsonの「two-hitモデル」のように一方の対立遺伝子に変異が生じたのち,片方の対立遺伝子の欠失や遺伝子変換(gene conversion)などによりヘテロ接合性の消失(loss of heterozygosity:LOH)が生じる場合(図1-4-5A,B),②一方の対立遺伝子の変異に加え,片方の対立遺伝子のプロモーター領域のメチル化による遺伝子のサイレンシングが起きる場合(図1-4-5C),③両方の対立遺伝子のプロモーター領域がメチル化され,遺伝子がサイレンシングされる場合などが考えられる(図1-4-5D).最近では,古典的なtwo-hit型の癌抑制遺伝子とは異なり,④片方の対立遺伝子の機能喪失だけでも発癌に対する感受性が正常細胞に比べて亢進する現象が観察されている(図1-4-5E,F).この現象はhaploid insufficiency(あるいはhaploinsufficiency)とよばれる.
(4)機能性RNAの活性化・不活性化による発癌機構
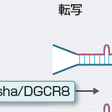
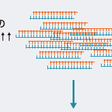
機能性RNAとは,それ自体が機能的役割をもったRNA分子の総称であり,一般には蛋白質に翻訳されないnon-coding RNA(ncRNA)と同義で使われることが多い.重要なncRNAとして,翻訳にかかわるtransfer RNA(tRNA),RNAスプライシングなどにかかわるsnRNAなどが知られていたが,近年,新たな種類のncRNAの存在が明らかになってきた.マイクロRNA (microRNA,miRNA)は,19-25ヌクレオチド長の一本鎖RNAであるが,ヒトゲノム中に1000〜2000程度存在する.各miRNAは,前駆体RNAより複雑なプロセシング(processing)を受けて生成された後,その結合蛋白とRISCとよばれる複合体を構成し,標的遺伝子のmRNAの分解促進,または翻訳抑制を介した遺伝子抑制を介して,発癌過程を含めたさまざまな生物学的現象の調節に働く(図1-4-6).一般に発癌過程においては,発癌促進に働くmiRNAの活性化や,抑制に働くmiRNAの不活性化が頻繁に認められる(図1-4-7).前者の例としては,miR-21,miR-17〜92 clusterなどがあり,後者の例としては,let-7,miR-34などがあげられる.これら発癌関連miRNAは,癌の診断,治療における有用性が示唆されている.long non-coding RNA(lncRNA)は200ヌクレオチド長以上の比較的サイズの大きい機能性RNAであるが,一部のlncRNAはクロマチン制御因子を特定の遺伝子プロモーターに引きつける分子として働くことが知られている.これらlncRNAの活性化は,クロマチン制御を介したエピジェネティックな遺伝子発現変化を介して発癌を促進すると考えられる.
(5)多段階発癌モデル
癌細胞の特性としては,①増殖シグナルに依存しない自立的かつ無制限の増殖能の獲得,②細胞死(アポトーシス)に対する抵抗性の獲得,③細胞極性の消失,④運動能の亢進,⑤新生血管の誘導,⑥浸潤能・転移能の獲得,⑦免疫学的排除機構(immunosurveillance)からの回避,⑧上皮・間葉系細胞の相互作用にかかわる癌微小環境の変化,などがあげられる(Hanahanら,2011).癌細胞は,多段階的に種々の癌遺伝子および癌抑制遺伝子の変異やエピジェネティックな変化を蓄積することにより,これらの特性を順次獲得すると考えられる(「癌の多段階発癌モデル」)(図1-4-8).すなわち,何らかの外的あるいは内的要因により癌遺伝子あるいは癌抑制遺伝子に変異が生じることにより,変異が導入された細胞は,その変異が周囲の正常細胞に比較してより生存に有利な場合に選択的に増殖を開始する(クローナルな増殖).アポトーシスに対する抵抗性の獲得やテロメアーゼ活性の亢進によるテロメア長の維持もまた,結果的に細胞に増殖能の賦与をもたらすことになる.増殖能を増した細胞(増殖性病変)にさらに段階的に複数の遺伝子変化が生じることにより,細胞極性や細胞間接着の消失,運動能・浸潤能の亢進による転移能の獲得など,段階的により悪性度が増した癌細胞へと変化していくことになる.
正常細胞が癌細胞になるまでに何個の癌遺伝子あるいは癌抑制遺伝子に変異が入る必要があるのかという問いに対する明確な答えはないが,ArmitageとDollらの年齢と癌発生率の関係に関する解析やKnudsonの数理モデルによるn=5~7個程度(よりおおまかには高々10個程度)という数値が,癌発生の律速段階(rate-limiting step)にかかわる遺伝子のヒット数としては妥当なものと考えられる.この際に注意しなければならないのは,癌化に至るまでに必要な遺伝子変異の種類が個々の症例において必ずしも同一ではないということである.たとえば大腸癌の場合に,初期段階でのAPC遺伝子あるいはβ-catenin遺伝子の変異に加え,K-ras,SMAD4,p53などの遺伝子変異や,プロモーター領域のメチル化状態の変化による遺伝子発現異常が段階的に蓄積されるモデルがVogelsteinらにより提唱されているが,個々の症例でこれらの遺伝子変異をすべて有しているものは決して多くないことが知られている.おそらくは,それぞれの遺伝子異常を代替するような別の変異あるいは機能異常が生じているものと考えられる.このことが,癌自体が「個性」をもつといわれるゆえんでもある.今後,個々の症例において癌発生過程での多段階的な遺伝子異常を把握することが可能となれば,個々人に応じた最適な治療法や癌予防のためのより有効な方策を実現することが期待できる.[中釜 斉]
■文献
Kinzler KW, Vogelstein B: Lessons from hereditary colorectal cancer. Cell, 87: 159-170, 1996.
Soda, M, et al: Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature, 448: 561-566, 2007.
Hanahan D, Weinberg RA: Hallmarks of Cancer: the next generation. Cell, 144: 646-674, 2011.
出典 内科学 第10版内科学 第10版について 情報