改訂新版 世界大百科事典 「酸塩基平衡」の意味・わかりやすい解説
酸塩基平衡 (さんえんきへいこう)
acid-base balance
生体では,複雑な生化学的反応を一定に保つために,体液の水素イオン濃度[H⁺]をきわめて狭い範囲に保つように調節機構が働いている。この平衡状態を酸塩基平衡という。体液の水素イオン濃度は生体のホメオスタシスによって保たれるが,このうち最も重要なのは体液の中に溶けている弱酸とその共役塩基で構成されている緩衝系である。体液中の緩衝系は機能的に二つに大別することができる。一つは炭酸と炭酸水素塩からなる炭酸緩衝系で,他は非炭酸系である。このうち前者は体液の酸塩基平衡の維持にとくに重要な系で生理的緩衝系とも呼ばれる。この緩衝系は体液中に物理的に溶解している二酸化炭素CO2の濃度が呼吸系によって,また細胞外液中の炭酸水素イオンの濃度[HCO3⁻]が腎臓の働きで調節されている。一方,非炭酸系の緩衝系としてはリン酸系,各種タンパク質,アミノ酸などがあり,これらは組織細胞における酸塩基平衡に大きな役割を果たしている。体液はこれらの系からなる複合緩衝系をなしているが,正常の機能を営んでいる生体では炭酸・炭酸水素系によって酸-塩基の割合が調節されており,それによってきまるpHによって他の緩衝系のそれぞれの酸-塩基の割合も化学的に平衡している。そのような複合緩衝系の酸-塩基の平衡の原理を等水素イオン濃度の原理という。
二酸化炭素は水に溶けると次のように炭酸H2CO3を生じ,H2CO3は解離して次のように平衡する。
CO2+H2O⇄H2CO3⇄H⁺+HCO3⁻ ……(1)
この解離平衡をヘンダーソン=ハッセルバルヒの式で表すと,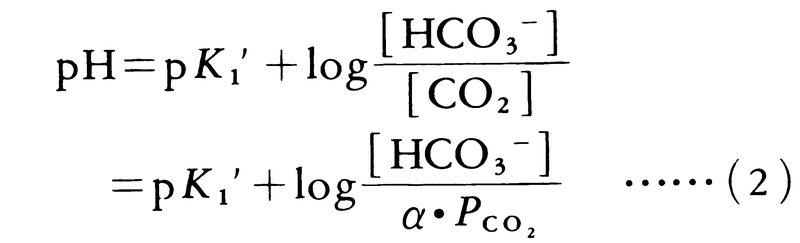
となる。pHは-log[H⁺],pK1′は物理的に溶解した二酸化炭素のH⁺+HCO3⁻までの解離の解離指数(血漿37℃で6.1)である。またPCO2は溶液中の二酸化炭素分圧であり,αはCO2の溶解度係数を意味する。細胞外液の[HCO3⁻]は通常一定(動脈血で24mmol)に保たれているが,これは腎臓の近位尿細管でのHCO3⁻再吸収量の調節によっている。通常,動脈血は肺のPCO2(40mmHg)に平衡しており,αは血漿(37℃)では0.03であるからlog[HCO3⁻]/α・PCO2は1.3となる。pK1′は6.1であるので,したがってpHは7.4となる。この式は生体の酸塩基平衡の状態を表すのに臨床的にも用いられる。呼吸機能や腎機能の異常または体内で過剰に酸が産生された場合は[HCO3⁻],PCO2の値が正常値より変位してくる。[HCO3⁻]/α・PCO2の値が小さくなるとpHが低下(酸性化)するが,そのような状態をアシドーシスといい,[HCO3⁻]/α・PCO2の値が大となりpHが高くなる状態をアルカローシスという。呼吸系に原因があって異常となる場合は呼吸性アシドーシスまたは呼吸性アルカローシスといい,腎機能の障害や過剰な酸の産生(たとえば糖尿病などの場合)で[HCO3⁻]が低くなっている場合を代謝性アシドーシスという。また有機酸のNa⁺塩や重曹を多量にとると[HCO3⁻]が上昇し代謝性アルカローシスとなる。生体の体液のpHはごく狭い範囲に調節されているが,アシドーシス,アルカローシスがひどくなりpHが7.2以下になると意識が障害され,7.1以下では死の危険がある。またpHが7.8以上になると痙攣(けいれん)またはテタニーの状態となる。
執筆者:星 猛+日向 正義
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報

