内科学 第10版 「C型慢性肝炎」の解説
C型慢性肝炎(ウイルス性慢性肝炎)
定義
C型肝炎ウイルスによる持続性の肝障害が6カ月以上みられ,病理学的に肝の門脈域を中心とする壊死や炎症反応がみられるものをいう.輸血や注射針の回し打ちなどでC型肝炎ウイルス(HCV)が感染し,キャリアとなる.7割が持続感染に移行し,HCVキャリアのなかで約90%以上が慢性肝炎となり,無症候性キャリアはほとんどいない.慢性肝炎が持続すると,30~35年の自然経過で肝硬変に進展し,さらに肝癌を発症する場合が多い.HCVキャリアのうち約4割が肝硬変や肝癌に移行すると考えられる.
C型肝炎はわが国における肝癌および肝硬変の原因として重要な位置を占めている.すなわち,わが国では年間約3万4000人が肝癌で死亡しているが,原発性肝癌の99%は肝細胞癌であり,肝細胞癌の70~75%はC型肝炎が原因である.この病態を把握し,適切に治療することが重要である.
感染経路
HCVは血液を介して感染する.体液で感染することはない.1992年にHCV抗体を測定できるようになるまでは,輸血による感染が多かった.1995年までは血液製剤によるHCVの感染がみられたが,輸血に用いる血液のHCV抗体が測定できるようになってからは,新規の感染が減少し,現在では血液透析施設以外では感染は発生していない.血液が付着した針が感染源となるため,医療従事者の感染がみられるが,それ以外は刺青や注射の廻しうちによる感染がある.
経過
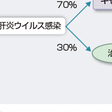
HCVの感染が起こると,3割の症例ではウイルスが排除されて治癒に至るが,7割は持続感染となりキャリアとなる.HCVの感染から平均20年から40年の経過で肝硬変や肝癌を発症することが多い.HCV感染者のうち4割が肝硬変や肝癌へと進行すると考えられている(田中ら,2011)(図9-4-3).経過中に重症化することはまれで,徐々に線維化が進行する.慢性肝炎の初期の肝線維化が初期段階での肝発癌率は年間0.5~1%と低いが,線維化の進行とともに肝発癌率が高くなり,肝硬変では年間7%程度の肝発癌がみられる.自覚症状はほとんどなく,身体所見では肝硬変に進行した場合にくも状血管拡張や手掌紅斑,女性化乳房や腹水がみられる.
病理
HCVが感染した肝細胞を細胞性免疫によって排除する機構が働き,慢性肝炎となる.炎症の主体は,門脈域周囲であるが小葉内にも壊死炎症反応がみられる.線維化と炎症の程度が病理学的に分類されている.線維化は,軽度の場合は門脈域に限局する線維化で,F(fibrosis)1またはステージ1と呼称される.線維化が門脈域から進展し,隣の門脈域に向かっていく段階をF2またはステージ2という.さらに線維化が隣接する門脈域と連結するようになると,bridging fibrosisと呼称され,F3またはステージ3に分類される.線維化が進行し小葉を取り囲むようになるとF4,肝硬変となる(図9-4-4).活動性についてはアクティビティまたはグレーディングとして,その程度が分類される.門脈域に限局した壊死や炎症反応が観察される場合をA1またはグレード 1と呼称される.壊死炎症が門脈域周囲の1/3以下の範囲で小葉内に向かって広がり,piecemeal necrosis(切り崩し壊死)がみられるものをA2またはグレード2と分類されている.さらに,門脈域の1/3以上の広範囲に壊死炎症が小葉に向かって進展したものをA3またはグレード3と分類される.この分類は国際的に用いられている(図9-4-5).
血液検査所見
1)HCV感染の診断:
感染のスクリーニングは血中HCV抗体を測定し,CLEIA法で5.0 IU/mL以上の高力値の場合には感染していると判定される.1.0~5.0 IU/mLの低力値の場合には偽陽性や感染の既往が含まれるためHCV RNAを測定する必要がある.1.0 IU/mL未満の場合には陰性であるが,感染して2週間以内の初期には陰性の場合があり注意を要する.
HCV RNA陽性の場合には感染が確定される.現在HCV RNAの測定にはリアルタイムPCR法が用いられ,1~8 log IU/mLの範囲で定量性がある.またHCVには遺伝子型(genotype)がみられ,世界中では1型から6型までの感染がある.日本では遺伝子型1bが7割を占め最も多く,2a型が2割,2b型が1割を占めている.遺伝子判定以外に血中抗体を用いた判定が行われ,セロタイプ(血清型)1型は遺伝子型1a,1b型の場合に陽性となり,セロタイプ2型は遺伝子型2a,2b型の場合に陽性となる.
2)肝機能検査:
AST,ALTは肝細胞逸脱酵素であり,壊死・炎症の程度を反映する.肝での蛋白合成の指標として血清アルブミン値やコリンエステラーゼ値,プロトロンビン時間をみる.肝線維化の指標として血小板数,Ⅳ型コラーゲン7Sやヒアルロン酸が有用である.肝癌を合併することが多いため,αフェトプロテイン(AFP)およびPIVKAⅡを定期的に測定し早期発見につとめる.
3)ウイルスの詳しい検査:
HCVは変異に富むウイルスである.遺伝子型1b型では特定の部分の変異と治療効果が関連する.コア70番と91番の変異が治療開始後のHCVRNAの低下に関連し,結果としてウイルス排除(sustaied virological response:SVR)に強く関係する.SVRとは,インターフェロンなどの抗ウイルス療法終了24週間後にHCV RNAが陰性化していることと定義されている.特にコア70番が野生型だとペグインターフェロン(PEG IFN)αとリバビリン併用開始後のHCV RNA低下がよいが,変異型になるとHCV RNAが低下しない例が多く,結果としてSVR率が低い.
一方,HCVの非構造領域NS5Aに存在する2209-2248の40個のアミノ酸変異(interferon sensitivity determining region:ISDR) アミノの変異数が多いほどインターフェロン(IFN)の感受性が増加しSVR率が向上する.ISDRの変異が0個の野生型ではIFNの感受性が低く,4カ所以上の変異型では,IFN単独での治療効果が高い.PEG IFNαとリバビリン併用療法においてもISDRの変異が多いほどSVR率が高い.
4)宿主遺伝子の検査:
genome-wide association study(GWAS:網羅的遺伝子解析)を用いた宿主遺伝子の網羅的解析により,ヒト19番染色体上に存在しインターフェロンλをコードするIL28B近傍の一遺伝子多型(SNP)とPEG IFNα・リバビリン併用48週投与におけるウイルス学的治療効果との関連が明らかとなり,より精密な治療効果予測が可能となった(Geら,2009). 治療中にHCV RNAが減衰しない,いわゆるnull virological responder(NVR:無反応)ではIL28Bがマイナー対立遺伝子の頻度が高かった.今後治療を行う前にIL28Bを測定して治療方針を決めることが重要になる. 一方,リバビリン投与中に生ずる貧血に関連するSNPも発見され,イノシン三リン酸化酵素(inosine triphosphatase:ITPA)のSNPがCCのメジャー対立遺伝子であった場合には貧血になりやすく,CAやAAのminor alleleでは貧血になりにくい.これらの宿主遺伝子を測定して副作用を予測することも重要になる.
治療
基本的には表9-4-3のような指針となる.
1)PEG IFNとリバビリン併用療法:
わが国では遺伝子型1b型高ウイルス量の難治症例が7割を占めるが,PEG IFNα2b・リバビリン併用療法で43%にSVRが得られている.さらにHCV RNAの陰性化が12週以降に遅延する症例では72週間の期間延長治療によってSVR率が向上する.
遺伝子型2a,2b型については,PEG IFNαとリバビリン併用による24週間の治療で83%と高い.HCV RNAの陰性化が4週目以降になる症例では,治療期間を36~48週間に延長することでSVR率が改善する.
2)プロテアーゼ阻害薬:
最近のHCVに対する研究の進歩によって,HCVそのものを分子標的とした新しい抗ウイルス薬が次々に開発されている.最も開発が進んでいるのがHCVの非構造蛋白NS3セリンプロテアーゼを標的としたプロテアーゼ阻害薬である.
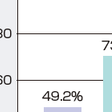
テラプレビルはその構造上,ペプチド類似の非環状(線状)型(acyclic,linear type)に分類される.単独投与では開始後早期にHCVプロテアーゼ阻害薬耐性変異を生じさせるため,臨床開発はおもにPEGIFNとリバビリンとの併用で行われている.日本で遺伝子型1型・高HCV RNA療症例を対象に開発治験が行われ,テラプレビルとPEG IFNα2b・リバビリン3剤併用12週間とPEG IFNα2b・リバビリン2剤併用12週間の合計24週間治療が行われ,初回治療ではSVR率が73.0%であった.これは対照となったPEG IFNα2bとリバビリン併用による48週間の治療の49.2%よりも有意に高かった(図9-4-6).さらに再治療についても解析された.前治療の際にいったんHCV RNAが陰性化した再燃例では3剤併用のSVR率が88.1%と高かったが,前治療時に一度もHCV RNAが陰性化しなかった無効例では,SVR率が34.4%であった(図9-4-6).症例のIL28Bがメジャー対立遺伝子の場合にはSVR率が90%以上と高いが,IL28Bがマイナー対立遺伝子の場合には30%台のSVR率である.副作用としては,貧血や皮疹などが指摘されており,特に皮膚症状は重篤となることがあり注意を要する.
3)ポリメラーゼ阻害薬:
HCVの非構造蛋白NS5Bは,RNAポリメラーゼ活性を有し,HC-RNA複製に重要な役割を果たしている.ポリメラーゼ阻害薬はHCVの複製を直接抑制する作用があり,核酸型,非核酸型の2種類の薬剤がある.多くの薬剤が開発されているが,GS7977が最も効果が高く耐性変異が出現しにくい.また,遺伝子型2や3型に対しても効果が高く,IFNなしで内服のみでSVR率が高いと報告され,期待されている.
4)NS5A阻害薬:
NS5A阻害薬の詳細な作用機序は不明であるが,副作用もきわめて少なく注目される薬剤である.NS5A阻害薬は,1日1回の内服によって高い抗ウイルス活性が認められる.遺伝子型1a型では耐性変異が出現しやすく,プロテアーゼ阻害薬との併用で内服薬のみではSVRが2/9であったが,PEG IFNαとリバビリン併用によって90%のSVRが得られる.特に遺伝子型1bではプロテアーゼ阻害薬との内服2剤のみの併用でのSVR率が高く,有望と期待されている.わが国ではPEG IFNαとリバビリン併用で治療中HCVRNAが陰性化しなかった無効例で,NS5Aとプロテアーゼ阻害薬内服のみでSVR率が90%であったと報告されている.
5)肝発癌防止を目指したPEG IFNα2a少量長期投与:
PEG IFNαとリバビリン併用によってSVRが得られなかった症例に対して,PEG IFNα2aの90 μgの週1回単独投与を行い,肝発癌を含む肝性脳症や食道静脈瘤などのイベントがどの程度抑制できるかについて,大規模多施設共同研究が行われた.3.5年の短期間の経過観察では,肝発癌を含めてイベント発生は抑制されなかったが,より長期間の経過観察を行うと肝硬変症例では,無治療経過観察例に比較して有意な肝発癌低下が認められた(Lokら,2011)(図9-4-7). わが国において,後ろ向き多施設共同(後から治療を受けた症例を集積して解析)が行われPEG IFNα2aの90 μgを週1回から2週に1回投与された症例では,肝庇護療法で治療された症例に比較して肝発癌率が低かった.またPEG IFNα2aが投与された594例で解析すると,治療開始24週間目のALTが40 IU/L以下に低下しているか,AFPが10 ng/mL以下に低下していた場合に肝発癌率が低いことが認められた.SVRが期待しにくい症例では肝発癌を防止する対策が重要と考えられる.[泉 並木]
■文献
Ge D, Fellay J, et al: Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature, 461: 399-401, 2009.
Lok AS, Everhart JE, et al: Maintenance peginterferon therapy and other factors associated with hepatocellular carcinoma in patients with advanced hepatitis C. Gastroenterology, 140: 840-849, 2011.
田中純子,片山惠子:B型肝炎,C型肝炎の疫学.Medical Practice, 28: 1347-1353, 2011.
出典 内科学 第10版内科学 第10版について 情報