内科学 第10版 「心筋代謝」の解説
心筋代謝(心血管代謝と機能)
(1)心臓の特異性
全身臓器のなかで心臓の特異的な点としてあげられるのが,自律的でかつ継続的な拍動・収縮である.致命的なリズムの乱れもなく1日約10万回,生涯にわたり約30億回拍動・収縮し続ける.1分間に約5 Lの血液を,生涯では約2億 L(20万トン)の血液を拍出するという仕事量を誇る.収縮弛緩を繰り返すだけではなく,前負荷・後負荷に応じて心拍出量を速やかに変化させる高い適応能力も備えている.長期間にわたる負荷に対しては心筋細胞の性質を変えてよりエネルギー効率のよい収縮を行うようになる.また,機能だけではなく形態も変化させることで負荷適応を可能にする.
(2)心筋のエネルギー代謝
a.エネルギー産生と貯蔵(図5-2-1)
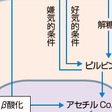
生体細胞はエネルギーの大部分をATP(アデノシン三リン酸)から得ている.心臓は多くの酸素を消費して1日に約35 kgものATPを産生する.心臓では動脈(冠動脈)から筋(心筋)への酸素摂取率が70%と,他臓器平均25%に比べるときわめて高い.
ATP産生に必要なエネルギー源は炭水化物(グルコースと乳酸)と脂質(脂肪酸)であるが,栄養摂取,運動によりこれらの比重はダイナミックに変化する.空腹時には,脂肪組織から動員された脂肪酸がミトコンドリアでβ酸化されることによりアセチルCoAが産生され,これがTCA回路,電子伝達系で利用されてエネルギー産生の約60%を担い,グルコースが約30%,乳酸は約10%を担う.グルコースは解糖系でピルビン酸を産生し,乳酸は乳酸脱水素酵素LDH(lactate dehydrogenase)の作用によりピルビン酸となり,ミトコンドリアでピルビン酸からアセチルCoAが産生され,ついでTCA回路,電子伝達系で利用される.食事後はこの比重が変化する.エネルギー産生の70%を解糖系,30%を乳酸が担い,脂肪酸はほとんど利用されない.激しい運動時には血中の乳酸が上昇し,エネルギー産生の60%を乳酸が担い,解糖系は15%,脂肪酸は20%程度とされる. ミトコンドリアの電子伝達系で多くの酸素を消費して効率的にATPが産生される(ADPの酸化的リン酸化).絶食,運動などでPGC-1α(核内受容体転写因子PPARγと会合する転写コアクチベーター)が活性化し,ミトコンドリア生合成や酸化的リン酸化能を高めてATP産生を増加させる.また,脂肪酸およびその誘導体がリガンドとして結合したPPARγはPGC-1α,RXRαと複合体を形成することにより転写因子として働き脂肪酸代謝に必要な酵素の発現を高め,心臓のエネルギー源をグルコースから脂肪酸へとシフトさせる. 心筋仕事量増大,カテコールアミン投与,虚血状態などは心筋のエネルギー需要を高める.冠動脈はそれに呼応して血流量を増加させ,より多くの酸素を心筋に供給する.ATPの代謝産物であるAMPの分解によって生ずるアデノシンがこの血管拡張に関与する. 心筋の画像診断で用いられるFDG-PETやBMIPPシンチグラムはそれぞれグルコースや脂肪酸の類似化合物の心筋への取り込みをみるものであり,心筋細胞が生存して活動しているか,またエネルギー産生状態がどうかを評価するのに有用である. ATPは心筋細胞内でクレアチンと結合し,クレアチンリン酸の形でエネルギーを蓄える.心筋収縮,カルシウムサイクリング,イオンの能動輸送などに必要なATPは,クレアチンキナーゼの作用でクレアチンリン酸から供給される(クレアチンリン酸+ADP→クレアチン+ATP).心筋のエネルギー需要が高まるとこの反応がさらに活性化する.心筋は骨格筋に比べてクレアチンリン酸の貯蔵が少ないので,虚血による影響を受けやすい臓器といえる.ATPはADPと無機リンとに分解される際にエネルギーを発生する.ADPはミトコンドリアでATPへと再生される.
b.ATPの利用と収縮弛緩(図5-2-2)
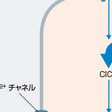
心筋で産生されたATPの約70%は心筋収縮に利用される.心筋ミオシン重鎖の頭部(アクチンとクロスブリッジする)はATPを分解する酵素活性(ミオシンATPase)をもち,ATP分解により得られた化学エネルギーを収縮という力学的エネルギーに変換する.ミオシンATPase活性は心筋収縮速度を反映し,酵素活性が高い心筋の方が収縮は速い. アクチンミオシンのクロスブリッジ運動は細胞内Ca2+濃度によって制御される.心筋細胞が電気的に興奮(脱分極)すると,細胞膜の電位依存性L型Ca2+チャネルを通って細胞外Ca2+が細胞内へと流入する.流入したCa2+が引き金となり筋小胞体(sarcoplasmic reticulum:SR)内のCa2+が心リアノジン受容体を通って細胞質内へと放出される(Ca2+-誘発性 Ca2+ 放出).このCa2+がサルコメアのトロポニンCに結合すると,トロポニンⅠによる抑制が外れ,アクチンがミオシンATPaseを活性化し,収縮が始まる.細胞質内のCa2+が上昇するとSR膜上のCa2+ATPase (SERCA)が活性化され,Ca2+をSR内へと汲み上げる.細胞質内のCa2+濃度低下によりトロポニン複合体による抑制が再開しミオシンATPaseの活性が低下し,心筋は弛緩する. このような収縮弛緩にかかわるATPase以外に,細胞内シグナル伝達を担うリン酸化酵素(キナーゼ)や心筋細胞の膜に存在するNa+-K+ ATPaseなどがATPを消費して,心筋代謝を担い,細胞内ホメオスタシスを保っている.
(3)心筋の蛋白代謝
心筋は体内でも蛋白代謝が非常に活発な組織である.小動物における心筋ミオシンの蛋白代謝の検討では,毎日全体量の10~15%が合成され,同じ量が分解されるなど蛋白代謝が活発である(骨格筋では5%程度にすぎない).心筋では負荷が増すと蛋白合成率を上げて肥大する.このとき蛋白合成の場であるリボソームRNA自体が増加するが,それに加えて単位リボソームあたりの合成効率も上がり,蛋白合成量は大いに増加しうる.また,病態に応じて遺伝子・蛋白発現プロファイルをダイナミックに変化させ負荷に適応しようとする.遺伝子発現プロファイルのダイナミックな変化には,microRNA(19〜25塩基からなるRNA)ネットワークによる発現調節が関与していることが明らかになってきた.
(4)神経液性因子による心筋代謝,心血管機能の調節
心臓は内分泌臓器でもある.ANP(心房性ナトリウム利尿ペプチド),BNP(脳性ナトリウム利尿ペプチド)は心不全の際に心室筋から分泌され,ナトリウム利尿を促進し心不全を改善する方向に作用する.ANPは心不全治療薬として使用されているし,BNPは心不全,心筋への負荷を鋭敏に反映するバイオマーカーとして血中濃度測定が広く行われている.肝臓で合成されたアンジオテンシノーゲンは血中のレニンによりアンジオテンシンⅠ,ついで血管内皮細胞に存在するアンジオテンシン変換酵素によりアンジオテンシンⅡに変換される.心筋にもアンジオテンシノーゲン,アンジオテンシン変換酵素が存在し,心筋負荷に応じて局所ホルモンとしてアンジオテンシンⅡが産生され心肥大,心筋間質線維化などに関連する強力な生理活性物質として作用している.アンジオテンシンⅡによる心肥大にはCa2+/カルモジュリン依存性にリン酸化されるカルシニューリン活性化やMAPキナーゼ経路活性化などが関与する.アンジオテンシンⅡ作用を抑える薬剤は高血圧症,心不全の治療薬として確立している.またエンドセリンも強力な血管収縮物質であると同時に心不全心筋から分泌され心肥大,心筋間質線維化を引き起こすことが知られる. このように液性因子に関しては全身を循環するホルモンとしてだけではなく,心筋局所で産生され作用する,という観点からも重要である.また,心筋細胞-心線維芽細胞連関,実質と間質との連関という視点も重要である.「心筋細胞(実質)が収縮弛緩を担い,間質は単に心筋細胞間の隙間を埋めているだけ」というわけではない.間質と実質とは相互に影響を与え合いつつ,ともに心筋の機能・構造再構築に大きな役割を果たしている.アンジオテンシンⅡが間質の線維芽細胞に作用するとエンドセリン,IL-6,bFGFを分泌,これらが心筋細胞の肥大をもたらし(パラクリン機序),さらに線維芽細胞自体の活性化を促す(オートクリン機序).アンジオテンシンⅡの心筋線維化作用に関しても,アンジオテンシンⅡが心筋細胞に作用してTGFβを誘導し,これが線維芽細胞活性化を促すという経路(パラクリン機序)と,線維芽細胞に作用してTGFβを誘導し,それが線維芽細胞自体の活性化を促すという経路(オートクリン機序)とが知られる.
自律神経系も心機能,心筋代謝を制御する重要な要因である.交感神経によるβ受容体刺激はGs蛋白,ついでアデニル酸シクラーゼを活性化し細胞内ATPからcAMPへの変換が亢進,さらにプロテインキナーゼA(PKA)を活性化する(図5-2-2).PKAは細胞膜の電位依存性L型Ca2+チャネルをリン酸化してCa2+流入を増加させるため,心筋収縮力を高める.また,PKAはホスホランバン(SERCAを抑制している)をリン酸化し抑制するため,SERCAが活性化され,心筋の拡張機能は亢進し,ひいては収縮機能も亢進する.副交感神経末端から分泌されるアセチルコリンは心筋ムスカリン受容体に結合しGi蛋白を活性化,これがβ受容体刺激によるアデニル酸シクラーゼ活性化を抑制するために心筋収縮力は低下する.一方,洞結節細胞にアセチルコリンが作用するとKAchチャネルが活性化し,K+が細胞外に流出するために洞結節自動能が抑制され徐脈になる.
(5)心筋に内在する遺伝子発現プログラム
心臓の形態形成や心筋細胞の分化に関与する転写因子としてCsx/Nkx2.5,GATA4/5/6,Mef2c,Tbx5,Hand1/2など,また関連液性因子としてBMP,Wntシグナル関連物質などが知られている.心臓分化の制御機構がさらに解明されれば,新しい治療法開発につながる.
(6)心筋代謝からみた心臓の病態
a.虚血心筋におけるエネルギー産生障害と細胞傷害
虚血や低酸素状態の心筋ではまず,ATPやクレアチンリン酸など高エネルギー化合物が減少する.多くのエネルギーを要する心筋収縮がはじめに障害を受ける.虚血が軽度の場合,ATP産生の中心は脂肪酸β酸化から解糖系にシフトする.しかしこれは嫌気的解糖系であるので産生されたピルビン酸はTCA回路で利用されず,LDHにより乳酸に変換され細胞内に蓄積し,一部は心筋外に流出する.心筋梗塞をきたすような高度の虚血では脂肪酸β酸化と解糖系はともに障害され,ATP産生は停止する.さまざまな脂質代謝産物,活性酸素が細胞膜を傷害し,細胞内のATPは枯渇し,代謝が進まなくなり細胞は死に至る.虚血による心筋壊死は心室壁内で必ずしも一様に進展するわけではない.心筋血流量が少なく,壁応力の高い心内膜側が先に傷害を受け,心外膜側へ時間とともに進展する(wave front現象).したがって,不可逆性の障害が完成する前に血流を再灌流させる,すみやかな血行再建療法が不可欠である.
b.負荷に対する適応と破綻
圧負荷や伸展刺激などに対して心筋は蛋白合成を速やかに高める.このとき蛋白合成の場であるリボソームRNAが増加するが,それに加えて単位リボソームあたりの合成効率も上がり,蛋白合成量は大いに増加しうる.また,病態に応じて遺伝子・蛋白発現プロファイルをダイナミックに変化させ負荷に適応しようとする.SR膜上のCa2+ATPase(SERCA)発現が減少する,ミオシンがαアイソフォームからβアイソフォームに変換する,骨格筋型アクチンの発現が亢進する,などである. また,肥大心や不全心ではPPARγ,PGC-1α,RXRαの活性が低下,脂肪酸酸化にかかわる遺伝子の発現が低下し,エネルギー基質が脂肪酸からグルコースへ変化するなど,エネルギー産生代謝のバランス障害が観察される.
心臓で局所的に産生される循環調節因子,成長因子,サイトカインなども心臓への負荷によってその産生分泌は大いに制御される.これらの変化は心臓への負荷に適応し,心不全状態を代償するために始まるが,行き過ぎた機能構造の変化は最終的に心不全状態を助長させる.負荷に応じて局所で産生されるアンジオテンシンⅡやエンドセリンが心肥大,心筋間質線維化などを促進させ心筋リモデリング,心機能障害をきたすことがよく知られる.また,酸素供給が減少した場合,低酸素誘導因子HIF-1αが活性化し,多数の遺伝子発現が変化し,代償機転として働くが,慢性虚血状態でHIF-1α依存性の遺伝子発現が持続することは心筋にとって有害である. 心機能維持に必要な代償反応なのか,それとも行き過ぎた代償で有害な反応なのかを見極め,治療のターゲットを正しく設定する必要がある.心臓における炎症性サイトカインTNFα出現は心不全を悪化させるが,慢性心不全の患者に抗TNFα中和抗体を投与すると心不全は悪化してしまったという臨床試験(RENEWAL試験)の報告は教訓的である.心不全における心筋代謝変化を細胞間ネットワークとして病態のフェーズごとにとらえ,適切な介入方法を考える必要がある.「心筋収縮を保つ,改善する」ことを達成するのが心不全の治療目標であることは確かであるが,現在,治療の根底にあるのは「心臓を休ませ,代謝を改善し収縮拡張を改善させ,長持ちさせる」という考え方である.その意味でも心筋代謝に関して正しく把握することはきわめて重要である.[森田啓行・永井良三]
■文献
Katz AM: Physiology of the Heart, 4th ed, Lippincott Williams & Wilkins, Philadelphia, 2006.
出典 内科学 第10版内科学 第10版について 情報