内科学 第10版 「本態性高血圧症」の解説
本態性高血圧症(血圧の異常)
血圧は心拍出量と末梢血管抵抗の積で規定され,この両者に影響する諸因子により血圧が調節されている.心拍出量に関与する因子としては心拍数・心収縮力と細胞外液量があり,末梢血管抵抗に影響するものとしては体液性因子を中心とする昇圧・降圧系の脈管作動物質や細胞内Na+,Ca2+などがある.表6-2-1にこれらのものを昇・降圧系に分けて示す.
本態性高血圧症は,これまで多くの研究にもかかわらず,今日なお原因不明の高血圧群であり,それゆえに一次性高血圧とも呼称される.原因不明ということは単一の病因を見いだしえないということでもあるが,現状では本症の成因としてはPage のモザイク説が示すように,化学的昇圧物質,神経性因子,血管弾性,心拍出量,血液粘性,血管内径,循環血液量,血管反応性など多くの血圧調節因子が高血圧の発症・維持にかかわるものと考えられている.
(1)遺伝因子
本態性高血圧症は,遺伝因子と環境因子の複雑な相関により発症する.多数例を総括的に検討した結果からは,発症に対する両者の関与はほぼ同程度と考えられる.ただし,個々の例についてみれば,それぞれの関与の程度は症例によって相違する.
遺伝様式は多因子遺伝と推測される.その詳細はなお未解決な分野が少なくないが,内分泌因子,交感神経系の反応亢進,食塩感受性,イオンの膜輸送異常などいくつかの病態生理,生化学的異常が遺伝的支配を受けていると考えられ,本症の発症機構に対するこれらのかかわりの解明が待たれる.
a.高血圧原因遺伝子
本態性高血圧原因遺伝子としても多くの候補遺伝子が指摘され,それらの高血圧成因とのかかわりが注目されている(表6-2-2).それぞれの血圧関連遺伝子の影響の程度には差があり,決定的な高血圧遺伝子座位はヒトではまだ同定されていない.
これらの中でも代表的な候補遺伝子の一つは,アンジオテンシノーゲンである.エクソン2のコドン174のThr→Met(T174M),235のMet→Thr(M235T)の2つの多型が高血圧と有意な関連を示すことが報告されている.特にM235T多型は高血圧の重症度,血中アンジオテンシノーゲン濃度とも相関し,高血圧の原因遺伝子の有力候補とされた.ACE遺伝子は,高血圧モデルラットにおける遺伝子解析で最も血圧と関連が深いとされる領域(ラット第10染色体上のBP-SP1)の近傍に位置しており,当初からACE/DD多型候補関連性が重要視されてきたが,ACE/DD多型と高血圧には相関が認められないとする報告もあり,高血圧との関係は必ずしも明らかではない.
最近では遺伝子解析技術のめざましい進歩により,ヒトの全ゲノムスキャンから表現型との関連を網羅的にスクリーニングする全ゲノム関連解析(genome-wide association study: GWAS)が主流になっている.わが国で2000年より行われていた,ミレニアム・ゲノム・プロジェクトの高血圧に関する成果も発表された.日本人1万4105人を対象に,GWASにおいて,ATP2B1,FGF5,CYP17A1,CSKの遺伝子が日本人の高血圧に関連していることが明らかとなった(Tabaraら,2010).さらに,高血圧の原因遺伝子解明を目的に設立された国際高血圧ゲノム解析コンソーシアムで,約26万人を対象とした遺伝子解析から,これまで指摘されていたATP2B1を含め,欧米人で28種,東アジア人で9種,南アジア人で6種の遺伝子が血圧と関連することが明らかにされている(International Consortium for BP GWASら,2011).一方で,上述のアンジオテンシノーゲンの遺伝子多型には弱い相関がみられるが,ACEの多型あるいは食塩感受性に関連する遺伝子には有意な相関は認められていない.
国際高血圧ゲノム解析コンソーシアムは,全世界の200をこえる研究機関による史上最大のヒトゲノム研究であり,高血圧の成因に関連する遺伝子は確認されていないが,これら遺伝子とその蛋白質を解析することにより,個々人の遺伝子に合わせた予防・治療法の選択,また新たな創薬開発が可能となることが期待される.
(2)環境因子
環境因子として最も重要なものに食塩の過剰摂取がある.食塩摂取量と収縮期血圧は良好な正相関を示し,食塩摂取が多い集団ほど高血圧が発症しやすいことはこれまでの研究からも明らかである.高血圧患者では食塩負荷に対して血圧が著明に上昇する患者から,血圧がほぼ同じレベルにとどまる患者まで分布し,食塩感受性には個体差がある.食塩感受性はおもに腎Na+排泄能など遺伝因子ならびにストレスなどの環境因子とのかかわりで決定されると考えられるが,食塩感受性を規定する候補遺伝子も明らかになっている.一般に腎機能低下,高齢,肥満,血漿レニン低値を認める症例で食塩感受性が高い.これ以外の環境因子としては,肥満,運動不足,ストレスなどがあげられ,これらの要因は後述のインスリン抵抗性の増悪にも密接に関与する.
(3)神経性因子
本態性高血圧の発症・維持に自律神経系の異常が関与している可能性が以前から指摘されている.事実,本態性高血圧患者ではさまざまな自律神経性血圧調節機構の異常が報告されている.自律神経系による血圧調節は急激な血圧変化に対しても最も有効に機能することが知られているが,本態性高血圧にみられるような基礎血圧の上昇にどの程度関与しているかは必ずしも明らかではない.
a.中枢神経性自律神経活動調節
交感神経活動は,脳幹部および上位中枢(視床下部,扁桃核,その他)の多くのニューロンにより調節されている.交感神経活動亢進をもたらすニューロンの興奮,あるいは交感神経活動を抑制するニューロン活動の減弱により交感神経活動亢進が生じる.動物では脳幹部の孤束核やA2ニューロンの破壊により,交感神経活動亢進に起因する高血圧が生じることが示されている.交感神経活動調節に関与するニューロンの活動性は,カテコールアミン,アンジオテンシン,グルタミン酸,γ-アミノ酪酸(GABA)など多くの神経化学物質の影響を受けている.これらの神経化学物質あるいは修飾物質の変化により,交感神経活動が亢進し,高血圧が発症する可能性が高血圧自然発症ラット(SHR)動物実験で示唆されているが,本態性高血圧患者における中枢神経性の関与については方法論上の問題もあり,必ずしも明らかとはなっていない.
b.交感神経系
本態性高血圧症の成因上で,代表的な昇圧系である交感神経系がいかにかかわるかについては,心拍出量や末梢血管抵抗の増大,あるいは腎におけるNa貯留作用など,数多くの機転が考えられている.特に若年,軽症,正レニンの高血圧患者の昇圧に交感神経系がかなり重要な役割を果たしている可能性が強く示唆される.腎血管抵抗の増大を介してこの系が関与していることも考えられる.
ストレスによる交感神経活性の増加は,高血圧症の発症において重要であると考えられている.ヒトでは精神的ストレス時に交感神経活性の増加とともに副腎髄質が活性化され,血漿アドレナリンが上昇して,心拍出量,心拍数,平均血圧および腎を含む内臓諸器官の血管抵抗の増加をきたす.
c.腎交感神経
高血圧の発症および進行に,腎交感神経活動の亢進が関与していることが示唆されている.腎交感神経活性亢進は,中枢神経系に対する求心性神経回路を介して中枢神経系を刺激し,遠心性神経回路を介して末梢交感神経活動を活性化し,腎でのNa貯留を介して,血圧が上昇する.腎交感神経活性化と腎レニン-アンジオテンシン系活性化は相互に刺激するため,レニン-アンジオテンシン系活性亢進も直接昇圧に関与するとともに中枢神経系を活性化し昇圧に関連する.最近,複数の降圧薬によっても治療効果の認められない治療抵抗性高血圧に対して,腎動脈周囲にある交感神経を焼灼(アブレーション)する新しい治療法が報告された.6カ月後の血圧は,治療群の84%の患者で収縮期10 mmHg以上の減少が認められ,収縮期/拡張期血圧が平均32/12 mmHg減少したのに対し,コントロール群は有意な血圧の低下を認めなかった(Symplicity, 2010).腎交感神経焼灼が有効であることは,腎交感神経活性亢進が高血圧の成因に関与することも示唆している.
(4)内分泌性因子
a.レニン-アンジオテンシン系
表6-2-1に示したように,血圧調節に関連する多くの内分泌性因子があるが,ここでは,昇圧系において特に重要なレニン-アンジオテンシン系を中心に述べる.レニン-アンジオテンシン系は,活性物質アンジオテンシンⅡを産生し,この作用により,末梢血管収縮,腎血行動態を介する水・Naの貯留,さらにはアルドステロン分泌を介して電解質代謝にあずかるなど各種の機序を介して血圧調節に重要な役割を演じている.図6-2-2にレニンの産生部位と生成刺激系を示す.本系は本態性高血圧患者の10%前後を占める高レニン本態性高血圧患者において,特に重要な役割を果たしているものと思われる.これらの患者ではレニン-アンジオテンシン系の抑制薬が著明な降圧を引き起こすことも本系の昇圧機序へのかかわりを強く示唆する.一般に高レニン患者は若年者に多く,これらの例では血漿ノルアドレナリン値が高値を示すものが多い.それゆえ,本系は交感神経系とも密接な関連を有して,本症の成因にかかわることが推測される.
b.降圧系
腎にはドパミン系,カリクレイン-キニン系,プロスタグランジン系といずれも腎に由来する降圧・Na利尿系が存在する.これら腎性降圧系の異常(抑制) は,水・Na貯留を介して本症の成因に関与する可能性が考えられる.事実,腎ドパミン活性は,尿中遊離ドパミン排泄量や外因性ドパミンに対する反応性の成績により,本症,特に低レニン群での抑制が報告されている.腎カリクレイン-キニン系は多くの因子よりなり,この系の作動物質キニンを産生・代謝する.本症においては,カリクレインの産生低下とキニネースⅠの活性亢進により系の活性は著明に抑制されており,この抑制はことさら低レニン患者群で著しい.他方,尿中プロスタグランジンE2排泄量も本症患者で有意に低下しているが,正・低レニン患者群間には差がみられない.このように,腎性降圧系は本症ではいずれも顕著な抑制ないしはその傾向にあり,この種の変化は特に低レニン患者群で著しい.一方,以上に述べた諸系間には相互関連性があり,個々の系の役割に加えて,3つの系が腎性降圧系として相互に関連しながら本症の成立にあずかっている可能性も考えられる.
一方,心房性Na利尿ペプチド(ANP)や,アドレノメジュリンの血中濃度は本症や多くの二次性高血圧でむしろ増大しており,高血圧の成因上大きな役割を果たしている可能性は少ないと考えられ,むしろ,昇圧・体液量増加に対する防御的増加と思われる.
(5)腎性因子
本態性高血圧患者の体液量は,正常かむしろ低値を示すものが多い.通常は,血圧が上昇すると,組織間への体液の浸出や圧利尿のため,循環血液量は減少する.したがって,血圧が高値である本症患者の体液量が正常ということは,むしろ相対的に増大していると考えねばならない.本症患者の体液量はレニン別でみると低レニンが最も高く,正レニン・高レニン群と低下し,年齢別では高齢者が最も高く,中・若年と減少し,また,重症度からみた場合,重症度の進展とともに体液量は増大する.体液量増大の機序には,腎の遺伝的Na排泄障害がまず考えられ,本症の成因に関する前述の各種仮説においても重要な昇圧機序の1つとして取り上げられている.また,前述のように,諸種の腎降圧系はNa利尿的に働いて血圧調節に関与する.
腎の体液量調節に,アルドステロンや抗利尿ホルモン,心房性Na利尿ペプチドなどの液性因子の作用に加えて,腎臓自体に内在している生理的な調節メカニズムが適正な体液量の維持に重要である.そして,このような腎の体液バランス維持能力の破綻により生じる慢性的な体液量の異常を通じ,高血圧が発症してくるものと考えられている.
腎臓自体の体液調節機序の1つとして,最近尿細管フィードバック機構が注目されている.遠位尿細管の流れを増加させると腎糸球体における濾過が減少する現象は,尿細管糸球体フィードバック機構とよばれる.体液量の維持に重要な役割を果たすと考えられる尿細管糸球体フィードバックが高血圧の発症に関与するという直接の証拠はまだないが,高血圧モデル動物において尿細管糸球体フィードバックの活動度が亢進していることが認められ,傍糸球体装置・尿細管糸球体フィードバックの異常が高血圧の発症に関与する可能性も考えられ,本態性高血圧での本機構の役割の解明が待たれる.
(6)インスリン抵抗性と高血圧
本態性高血圧の背景にはインスリン感受性の低下と代償的高インスリン血症が存在し,高血圧の成因・維持機構のみならず動脈硬化性合併症にも密接に関係することが指摘され,インスリン抵抗性症候群として注目されてきている.
Reavenらは糖脂質代謝異常と高血圧の成因にインスリン抵抗性が関与し,動脈硬化を生じて心血管疾患に進展するという“シンドローム X”という概念を提唱した.DeFronzoらは,動脈硬化性疾患も加えてインスリン抵抗性症候群を提唱し,松沢らは内臓脂肪蓄積がインスリン抵抗性を含む耐糖能異常,高血圧,高中性脂肪血症を続発させる観点から内臓脂肪症候群という考え方を提唱している.米国のNational Cholesterol Education Program(NCEP)のATPⅢ(2001)においては,本症候群に対してメタボリック症候群の呼称を提唱し,特に累積する危険因子の厳格な管理を提唱している.
インスリン抵抗性とはおもに骨格筋でのインスリンによる糖の取り込み能が選択的に低下している状態である.インスリン抵抗性の原因としては遺伝的素因のほか,肥満,運動不足,過食などの環境的因子の影響を受けることが知られている.
ヒト膵島のβ細胞は一般にかなりの代償能を有しており,インスリン抵抗性に対しインスリン分泌を増加させることで糖代謝を代償する.したがって,膵β細胞のインスリン分泌能が低下したときには糖尿病の発症に至るが,インスリン分泌能が保たれていれば正常耐糖能か耐糖能異常(impaired glucose tolerance:IGT)に高インスリン血症を伴った状態を呈する.しかし,代償的高インスリン血症により耐糖能低下を防ぐことができたとしても,これが骨格筋以外の臓器・組織において肥満,耐糖能異常,脂質代謝異常(低HDL-コレステロール血症,高トリグリセリド血症)ならびに高血圧症を引き起こし,動脈硬化症を生じて最終的に心血管疾患を進展されるとするのが本仮説の考え方である.
最近,肥満遺伝子産物のレプチン分泌をインスリンが刺激,昇圧に関与することが報告される一方で,脂肪組織や骨格筋がTNF-α分泌などを介してインスリン感受性を低下させる可能性も報告されてきた.
2)診断・鑑別診断
(1)問診
高血圧患者は通常,無症状である.しかし,その背景とリスクは千差万別である.したがって,高血圧患者の診療では,①正確な血圧評価に基づく高血圧の診断,②生活習慣の把握,③ほかのリスク(心血管リスク因子,臓器障害,心血管疾患,合併症)の評価,さらに④二次性高血圧の除外を行い,徹底した個別診療を行う.
その第一歩となる問診では,高血圧の経過と治療歴,素因と生活習慣,さらに二次性高血圧や高血圧合併症,臓器障害の存在を疑わせる特異的症状の有無を詳細に確認する(表6-2-3).
1)高血圧歴と治療歴:
高血圧を指摘された時期とその状況(健診,診察時,自己測定など),持続期間,血圧レベルを聴取する.治療歴のある場合は,降圧薬の種類と有効性・副作用歴を確認する.さらに,高血圧リスクにつながる生下時低体重や幼少時期からの体重増加,体重増加の経過,妊娠歴がある女性では妊娠時の病歴(高血圧,糖尿病,蛋白尿を指摘されたかなど)を聴取する.
2)高血圧素因:
家族歴として,両親(父母別々)と兄弟姉妹の高血圧,糖尿病,心血管疾患の有無と発症年齢をきく.
3)生活習慣:
運動習慣(頻度と強度),睡眠習慣(睡眠時間と睡眠の質),食習慣(食事内容や塩分や甘いものなどの嗜好),飲酒・清涼飲料水ならびに喫煙(量と期間),性格と精神心理状態(不安感や抑うつ傾向),ストレス度(職場・家庭)を聴取し,生活習慣の全体像を把握する.
4)二次性高血圧を示唆する情報:
体重増加の経過やメタボリック症候群の合併に加えて,夜間頻尿や夜間呼吸困難,早朝の頭痛,昼間の眠気,抑うつ状態,集中力の低下などの自覚症状,さらにいびきや無呼吸を家族から指摘されたことがないかなどの睡眠時無呼吸症候群を疑う徴候を確認する.また,これまでの血尿,蛋白尿,夜間頻尿など腎臓病や,非ステロイド系抗炎症薬,漢方薬,経口避妊薬などの使用状況などを確認する.
5)臓器障害:
臓器障害や心血管疾患の病歴を聴取する.脳血管障害に関しては一過性脳虚血発作,筋力低下,めまい,頭痛,視力障害,心臓疾患に関しては呼吸困難(労作性・夜間発作),体重増加,下肢浮腫,動悸,胸痛,腎臓病に関しては多尿,夜間尿,血尿,蛋白尿,末梢動脈疾患に関しては間欠性跛行や下肢冷感などの症状の有無を確認する.
(2)診察(身体所見)(表6-2-4)
身体所見では,おもに血圧と血圧変動性,血管評価,心不全徴候,さらに二次性高血圧となる基礎疾患の有無を診察する.
まず,安静・坐位の血圧,脈拍のほか,初診時には血圧左右差や,血圧と脈拍の起立性変動を確認する.さらに,身長,体重を測定し,BMI[body mass index:体重(kg)/身長(m)2]を算出して,全身肥満を評価する.また,腹囲(臍周囲,立位測定)を測定し,腹部肥満を評価する.
局所所見として,皮膚所見では腹壁皮膚線条や多毛(Cushing症候群),顔面・頸部所見として,貧血・黄疸,甲状腺腫,頸動脈血管雑音,頸静脈怒張の有無や眼底所見を,胸部所見では心尖拍動とスリルの触知(最強点と触知範囲),心雑音,Ⅲ音,Ⅳ音,不整脈,および肺野のラ音の聴診を行う.腹部診察として,血管雑音とその放散方向,肝腫大と叩打痛,腎臓腫大(多発性囊胞腎),四肢は末梢動脈拍動(橈骨動脈,足背動脈,後脛骨動脈,大腿動脈)の触知(消失,減弱,左右差),冷感,虚血性潰瘍,浮腫,四肢の運動障害,感覚障害,腱反射亢進などを診察する.
血管総合評価として,上腕血圧の左右差に加え,下肢末梢血管の触知,頸動脈や腹部など血管雑音より,血管狭窄病変が何カ所あるかを記載する.
(3)高血圧の診断
血圧は絶えず変動していることから,高血圧の診断には正しい血圧測定が必要である.診察室血圧測定は安静坐位で,心臓の高さにカフを保ち,複数回測定し,安定した2回の平均を血圧値とする.
1)高血圧診断:
2回以上の異なる機会における診察室血圧値に基づいて行う.診察室血圧が収縮期血圧140 mmHg以上,または拡張期血圧が90 mmHg以上で高血圧と診断する.
2)正常高値血圧:
収縮期血圧130~139 mmHgまたは拡張期血圧 85~89 mmHg未満は正常高値血圧と分類される.正常高値群は,特に肥満や高心拍数を伴う若年者では,将来,高率に高血圧へ進展する.
3)収縮期高血圧:
収縮期血圧が140 mmHg以上,かつ拡張期血圧が 90 mmHg未満は収縮期高血圧と診断される.収縮期高血圧は,大血管硬化が進行した高齢者で高頻度にみられ,心血管リスクが高い.
a.診察室以外で測定した血圧に基づく高血圧診断
診察室血圧は医療環境下という特殊条件下で測定した血圧である.高血圧の診断と治療指針には,家庭血圧や24時間自由行動下血圧など,診察室以外で測定した血圧も活用する.家庭血圧や24時間血圧は,診察室血圧よりも心血管リスク因子としての価値が高い.
診察室血圧と,家庭血圧や24時間血圧は必ずしも一致せず,高血圧の診断閾値は,家庭血圧で135/85 mmHg以上,平均24時間血圧で130/80 mmHg以上である(表6-2-5).診察室血圧と診察室外血圧により,正常血圧,白衣高血圧,仮面高血圧,持続性高血圧の4つの分類がなされる(図6-2-3).
1)白衣高血圧:
「白衣高血圧」(white coat hypertension)は,診察室で測定した血圧が高血圧であっても,診察室外血圧では正常血圧を示す状態で,リスクは正常血圧と同程度か,やや高い.直ちに降圧療法の対象にはならないが,将来の高血圧のリスクが高いことから,家庭血圧による定期的な評価が必要である.
2)仮面高血圧:
「仮面高血圧」(masked hypertension)は診察室血圧が正常血圧で,診察室外の血圧が高血圧を示す状態で,リスクは高血圧と同程度以上に高いことから,降圧療法の対象となる.仮面高血圧は,血圧上昇が増大している時間帯の違いにより,大きく分けて,早朝高血圧,ストレス性高血圧,夜間高血圧の3つの表現型があり,それぞれ病態と関連因子が異なる(図6-2-4).
早朝高血圧は,アルコール多飲や喫煙起立性高血圧,大血管硬化の増大や持続時間の不十分な降圧薬によりみられることが多い.また,ストレス下高血圧は,職場や家庭の精神的ストレスにより昼間の血圧が上昇している.就業中の成人に多い.夜間高血圧は,循環血液量の増大,自律神経障害,さらに睡眠障害などによるサーカディアンリズムの異常により生じる.
b.診察室外の血圧評価
i)4時間自由行動下血圧測定(ambulatory blood pressure monitoring:ABPM)
ABPMは,間欠的に一定間隔(通常30分間隔)で24時間にわたり自由行動下の血圧を自動測定する.ABPMから得られる血圧指標の中で,臨床的に重要な指標は24時間血圧,血圧日内変動,さらに血圧モーニングサージである(表6-2-6).
ABPMによる高血圧診断の閾値は24時間血圧で130/80 mmHg,昼間血圧(昼間覚醒時の平均)で135/85 mmHg,夜間血圧(夜間睡眠中の平均)で120/70 mmHgである.ABPMでこの閾値をこえた場合,高血圧と診断する.診察室血圧と比較して,ABPMで測定した血圧は左室肥大,微量アルブミン尿,動脈硬化などの臓器障害や心血管疾患の発症,さらに死亡リスクと,より密接に相関する.
1)血圧日内変動:
ABPMでは血圧変動性を評価できる.そのうち,臨床的意義が最も明確なものが,サーカディアンリズム(日内変動)の異常である(図6-2-5).通常の血圧サーカディアンリズムは,就寝後,睡眠時午前3~4時頃に最低となった後,徐々に上昇し,覚醒とともに急峻に増加する日内変動を示す.昼間の血圧に比較して,夜間血圧が10~20%下降する正常サーカディアンリズム型を“dipper”とよぶ.
夜間血圧下降の少ない(10%未満)non-dipperや,逆に夜間血圧が上昇を示すriserでは,dipperと比較して,脳,心臓,腎臓の全標的臓器障害が進行しており,心血管イベントならびに心血管死亡のリスクが高い.また,夜間20%以上の過度の夜間血圧下降を示すextreme dipperも無症候性脳梗塞が進行しており,脳卒中発症のリスクも高い.
夜間血圧が下降しないnon-dipperやriserを示す夜間高血圧のメカニズムは多様である.うっ血性心不全や腎不全などの循環血液量の増加や,糖尿病やShy-Drager症候群など自律神経障害をきたす病態,原発性アルドステロン症やCushing症候群などの内分泌疾患による二次性高血圧などの病態でnon-dipperを生じる.また,睡眠時無呼吸症候群もnon-dipperやriser型血圧変動異常を伴い,夜間血圧の変動性が増大している.
2)血圧モーニングサージ:
血圧は早朝に急峻に上昇するモーニングサージを示す.血圧モーニングサージは血圧変動性の1つで,生理的現象であるが,著しいサージは,24時間血圧とは独立して脳卒中のリスクになる(図6-2-6).血圧モーニングサージは高齢者高血圧患者で増強しており,大血管・小血管血管傷害とも関連しており,脳梗塞や脳出血に加えて,心血管死亡や総死亡のリスクとなる.また,血圧モーニングサージには季節変動がみられ,冬季に増強する.
ⅱ)家庭血圧測定法
家庭血圧もABPMと同様に,診察室血圧よりも心血管リスクと密接に関連している.ABPMで測定した血圧と比較し,家庭血圧の有用な点として以下の2つがある.①ストレスが少ない一定条件下で測定することから再現性は良好で,継続して測定することにより,降圧薬の薬効評価や季節変動などの評価ができる.②自分自身で血圧を測定することから,降圧療法のアドヒランスも改善する.
家庭血圧による高血圧診断の閾値は,朝・晩の血圧の平均で135/85 mmHgで,この閾値をこえた場合に,高血圧と診断する(表6-2-5).また,降圧療法は,この血圧閾値未満を目指す.
家庭血圧の測定条件は,上腕カフ・オシロメトリック法に基づく装置を用いて,朝と晩の1日2機会,1機会に2回,安静・坐位1~2分後の血圧を測定する.朝の測定は,起床後1時間以内,排尿後,朝食・服薬前に行い,晩の測定は就床前に行う(表6-2-7).降圧療法中の患者では,診察室血圧や晩の家庭血圧が正常でも,翌朝には降圧薬の効果が減弱していることが多く,特に服薬前の早朝血圧の評価が重要である.朝と就寝前の血圧差(ME差)もリスクとなる.
(4)二次性高血圧との鑑別診断
問診,身体所見,一般臨床検査より二次性高血圧が疑われる場合,もしくは,利尿薬を含む降圧薬3剤以上を服用中にもかかわらず血圧コントロールが不良の治療抵抗性高血圧においては,積極的に表6-2-8にあげる二次性高血圧を除外する.
推奨されるスクリーニング検査として,早朝安静臥位30分後の採血にて,血中レニン-アルドステロン,コルチゾール,ACTH,カテコールアミン3分画などのホルモン検査,24時間蓄尿中のメタネフリン3分画,またはカテコールアミン3分画などがある【⇨6-3】.血中レニン活性やアルドステロンの評価には,影響を与えるACE阻害薬やアンジオテンシン受容体拮抗薬,β遮断薬,利尿薬などは,すべてカルシウム拮抗薬に変更してから行うのが望ましい.
睡眠時無呼吸症候群のスクリーニングとしては,簡易的に夜間の低酸素発作を評価する夜間経皮酸素分圧測定などがある.
二次性高血圧の確定診断に専門医が行う特殊検査として,副腎エコー・CT(造影を含む),腎血流エコー,腎血流シンチグラフィ,副腎シンチグラフィ,副腎静脈サンプリング,睡眠ポリグラフィなどがある.
3)高血圧と心血管疾患
高血圧は死亡の最も重要な危険因子の1つである.高血圧患者では早期に高血圧性臓器障害を発見することが重要であり,その重症度は心血管病の予後規定因子である.高血圧性臓器障害としては脳卒中,高血圧性網膜症,虚血性心疾患,心不全,蛋白尿,腎機能障害,動脈硬化に伴う動脈狭窄,動脈瘤などがある.高血圧診療においては,血圧値のみでなく,そのほかの心血管病のリスクの有無,高血圧性臓器障害および合併症の有無によって,リスクの層別化を行い,その治療方針を決定することが重要である.表6-2-9に高血圧性臓器障害の検査指標を示した.
(1)動脈硬化
高血圧による血管障害は,まず内皮機能障害が出現し,さらに血管の狭窄・拡大などのリモデリングに特徴づけられる.これらの変化は,血管拡張能の低下を招き,末梢血管抵抗はさらに上昇する.このような病変は加齢,高血圧,脂質異常症,糖尿病などの影響を受けて促進される.降圧治療効果の判定の指標として足首・上腕血圧比(ankle-brachial pressure index:ABI)や脈波伝導速度(pulse wave velocity:PWV)が有用である.最近,上腕-足首間のPWVおよびABIを同時測定可能な機器が開発され,簡便かつ再現よくPWVを測定することが可能になり有用である.
(2)眼底
高血圧の合併症として眼病変は,末梢血管抵抗増大を反映し網膜動脈の高血圧性変化と硬化性の変化として現れる.直接観察できることから高血圧重症度判定にはきわめて有用である.高血圧性眼底変化の分類としてKeith-Wagner分類がこれまで広く利用されていたが,最近ではScheie分類で評価することが多い.Scheie分類は高血圧性変化(H)と硬化性変化(S)を4段階で評価する(表6-2-10).H所見は末梢血管抵抗の増大に起因する網膜細動脈の狭細化を観察したものである.動脈の狭細化を判断するために,伴走する静脈を観察し,動静脈比からこれを判定する.狭細化病変があり,硬化性病変がない場合は,機能的狭細の可能性がある.S所見は血柱反射の亢進と動静脈交差現象である.血柱反射とは,眼底検査で血管を観察したときに,血管内の血液に照明が反射して血管の中央が輝いて見える現象のことである.動脈硬化で血管壁が厚くなると,反射部分の幅が太くなる.したがって,血柱反射の幅を測定することで,動脈硬化の程度を推定することができる.さらに動脈硬化が進行すると,銅線動脈(血柱反射が血管の幅と同じまで亢進し,血管があたかも銅線のように見える),銀線動脈(血管壁が不透明になり,血管が白く見える)とよばれる現象が認められる.これらの変化に加えて,網膜自体に血液や血液成分が染み出してできる出血斑・滲出斑,虚血に伴う軟性白斑,網膜浮腫などが観察されると高血圧性網膜症と診断される.
(3)脳
高血圧性臓器障害の中でも脳卒中の発症率は血圧値との相関が最も強く,血圧が高いほど脳卒中罹患率・死亡率が高くなる(図6-2-7).降圧治療の普及により血圧管理が行われるようになり,脳卒中,特に脳出血は著明に減少した.高血圧と最も関連するのは脳内小動脈病変が原因のラクナ梗塞であり,穿通枝領域に多く見られるため穿通枝梗塞ともよばれる.このほか頸部~頭蓋内の比較的大きな動脈の粥状動脈硬化に基づくアテローム血栓性脳梗塞,心房細動が原因である心原性脳塞栓症なども高血圧が大きなリスク因子になっている.一方,CTやMRIなどの画像診断の向上により脳卒中発症や認知症進行の予測因子である無症候性脳血管障害や慢性脳虚血病変の診断が可能になった.高血圧性臓器障害の1つである無症候性脳梗塞の診断にはMRI検査がきわめて有用である.無症候性脳血管病変は,T1強調画像でlow density,T2強調画像でhigh intensityを呈する病変である(図6-2-8 A).また,慢性虚血性病変としてT1強調画像でlow density,T2もしくはFLAIR強調画像でhigh intensityを呈する脳室周囲白質病変(periventricular hyperintensity:PVH)(図6-2-8 B)および深部皮質下白質病変(deep and subcortical white matter hyperintensity:DSWMH)(図6-2-8 C)などがある.最近,T2*強調画像で微小脳出血が確認されるようになり,高血圧,動脈硬化との関連が検討されている(図6-2-8 D).またMRアンギオグラフィは頭蓋内の主幹脳動脈や頸動脈の狭窄病変ならびに脳動脈瘤の検出に有用である.脳血流は自動調節能が備わっているため,血圧変動にかかわらず,脳血流は一定に保たれている.しかし,急激または著しい血圧上昇により脳血流の自動調節能が破綻し,必要以上の血流量と圧のため脳浮腫を生ずる(図6-2-9).この状態が高血圧性脳症で緊急に適切な治療をされなければ,脳出血,意識障害,痙攣などを伴い死に至ることもある.
(4)心臓
最初に出現する高血圧性臓器障害として左室肥大の有無の確認はきわめて重要である.左室肥大の進行は,心房細動,心不全,心臓突然死につながる可能性がある.逆に降圧療法による左室肥大の退縮はこれらの発症のリスクの低下につながる.心エコー検査は,左室肥大の定量化において心電図検査よりすぐれ,心機能評価も可能である.左室心筋重量は高血圧の重症度とともに増加し,脳卒中や心不全を含む心血管疾患の強力な規定因子である.左室の心筋肥大形式によって【⇨図5-2-4】に示すような分類がなされている.左室心筋重量(1.04×[(左室拡張末期径+中隔厚+後壁厚)3-(左室拡張末期径)3])を体表面積で補正した左室心筋重量係数に加えて,相対的左室壁厚([中隔厚+後壁厚]/左室拡張末期径)によって,正常,求心性リモデリング,求心性肥大,遠心性肥大に分類される.求心性肥大が最も強い心血管疾患のリスクであり,降圧療法によるこれらの左室肥大の改善が心血管疾患の予後の改善につながる.心肥大は圧負荷のみならず,交感神経系やレニン-アンジオテンシン系の亢進などを介して心筋肥大および線維化を促進する.心機能に関しては,高血圧によって収縮能が低下する前にまず拡張能が低下する.拡張能の低下は,左室肥大に先行してみられる場合もある.最近,収縮能は保たれているが,拡張能の低下により左室拡張末期圧が増大し心不全をきたすことが報告されている.基礎疾患として高血圧に伴う左室肥大・拡張能低下が原因であることが多く,高齢者,特に女性にその頻度が高い.もちろん,高血圧に伴って狭心症や心筋梗塞の発症も認めるが,高血圧との関連は脳卒中との関連より弱い.
(5)腎臓
高血圧によって糸球体硬化・腎間質の線維化が進行し,糸球体濾過値が低下する.高血圧に伴う腎硬化症は,糖尿病,慢性糸球体腎炎に次いで第三番目の透析導入の原因疾患である(2010年の全透析患者の7.5%).腎の組織学的変化は,輸入細動脈の硝子様変化と硬化,糸球体の硬化および尿細管萎縮を伴う間質の線維化である.腎機能の低下に伴い,体液量の増加が認められるようになり,血圧はさらに上昇するようになり悪循環を形成する.最近原因は問わず,腎機能低下(糸球体濾過値で60 mL/分/1.73m2)もしくは,蛋白尿などの尿異常を認める場合,慢性腎臓病(chronic kidney disease:CKD)という疾患概念が導入された.CKDは心血管病の重大な危険因子であり,CKDの進行抑制に最も重要なのが血圧の管理である.このような視点からも,高血圧の治療が重要である.高血圧による腎障害の指標の1つが糖尿病性腎症と同様に,蛋白尿およびアルブミン尿の存在である.アルブミン尿の測定には24時間蓄尿が正確であるが,外来で繰り返し行うには煩雑であり,尿中クレアチニンを同時に測定し,クレアチニン比で評価するのが一般的になっている.
加速度型-悪性高血圧では拡張期血圧が120〜130 mmHgであり,腎機能が急激に悪化し,心不全,高血圧性脳症,脳出血などを発症する.腎組織学的変化は,細動脈のフィブリノイド壊死と増殖性内膜炎であり,悪性腎硬化症とよばれる.近年では降圧治療薬の普及,生活環境の改善などから発症頻度は減少している.
(6)大動脈
急性大動脈解離は高血圧性緊急症の1つであり,迅速な降圧と鎮静および絶対安静を必要とする.大動脈瘤は無症状である場合が多く,健診や診察時に偶然発見されることが多い.しかしながら,破裂を起こすと致死的であるため,大動脈瘤と診断した場合は,瘤の拡大を見逃すことなく,外科的手術を考慮することが必要である.
(7)血圧変動
血圧が高いほど,臓器障害が進行することは明らかであるが,その血圧値に関しては,診察室の血圧と家庭血圧および24時間自由行動下血圧測定(ABPM)による血圧が存在する.特にABPMにより,医療環境下での血圧測定では高値で,非医療環境下では血圧が正常である白衣性高血圧の鑑別が可能であり,また,医療環境下の血圧は正常で非医療環境下では血圧が高値である仮面高血圧の診断が可能である.そしてABPMによる血圧値が,強く高血圧性臓器障害と関連することも報告されている.一般的には夜間は昼間と比較して血圧が低下するが,この低下度が減弱しているnon-dipper型(夜間の平均収縮期血圧の低下が昼間の10%未満)や逆に夜間に血圧が上昇するriser型は臓器障害が高度の場合が多く,心血管病発症のリスクである(図6-2-10).
4)予後
(1)高血圧の自然歴
高血圧の自然歴を最も簡略に示したのがcardiovascular continuum(心血管疾患の連続性)という概念であろう(図6-2-11)(Dzau ら, 2006).Framingham研究などの長期的な研究を総合的に解析すると,高血圧の自然歴は,動脈硬化性変化あるいは圧負荷の結果としての心肥大という経過をたどって心不全を中心とした臓器障害,最終的には多臓器不全となって死に至る.動脈硬化性病変により虚血性心疾患が発症すると,左室壁運動障害およびリモデリングなどによる収縮機能の低下が生じ最終的には心不全になる.また心臓が肥大してくると拡張機能の障害が起こり,最終的にはやはり収縮機能も減弱して心不全に移行する.また,心疾患と同様に脳卒中も動脈硬化性変化を経て脳梗塞や脳出血をきたす.高血圧から動脈硬化や心肥大へという変化は数年単位あるいは数十年単位の年月を要するが,一度心不全になると,数カ月から数年の予後であり,高血圧の自然歴は一様に進んでいくわけではない.
高血圧の自然歴に血圧そのものが非常に大きく関与していることは疫学研究からも明らかである.血圧との関連性が最も高いものが脳卒中であり,血圧水準が高いと脳卒中罹患率・死亡率が高くなる.高血圧と心疾患の関連も,脳卒中との関連性よりも弱いが,脳卒中と同様の関連を示す.心房細動は心原性脳塞栓症のリスクを著明に増加させて心血管事故発症率・死亡率が約2~5倍に増大するが,高血圧症は心房細動発症の最も重要な危険因子であり,特に左室肥大と左房拡大が心房細動新規発症の独立した危険因子である.さらに高血圧は慢性心房細動患者における脳卒中や動脈塞栓症のリスクをも増大させる.慢性腎臓病の患者は血圧水準が高いほど予後が悪く,脳卒中,心筋梗塞および総死亡リスクが高い.また,血圧管理は腎障害を軽減し,その後の心血管リスクの低下を促す.多くのコホート研究のメタ解析では,若年者から高齢者にわたり血圧値が高いほど循環器疾患罹患・死亡リスクが高いことが明らかとなっている.このことから,高血圧では血圧管理が重要課題となる.
(2)血圧の年次推移
国民健康・栄養調査による国民の血圧水準の推移は,測定成績のある1956年から上昇し,1965年頃最も高かったが,それ以降漸減した【⇨図6-1-3】.この血圧水準の推移に歩調を合わすようにして,わが国の年齢調整脳卒中死亡率は,第2次世界大戦後,感染症の克服とともに急速に上昇し1965年に頂点に達した【⇨図1-1-1】.かつてわが国に高血圧が多く脳卒中が多発した理由の1つとして,食塩の過剰摂取による血圧上昇があげられる.INTERSALT研究では24時間蓄尿でみた食塩摂取量の多い集団では血圧が高く,個人の食塩摂取量と血圧との間にも正の関連がある.現在の日本の食塩摂取量は1日11~12 g程度であると考えられるが,24時間蓄尿による過去の成績では1950年代の東北地方の食塩摂取量推定値は1日25 gにも達していた.1960年代より続けてきた減塩指導により低下し続けた食塩摂取により血圧も低下したものと考えられる.その後さらに,高い有効性と少ない副作用をもった降圧薬が数多く開発されて,降圧療法の進歩と普及に大きく貢献したものと考えられる.1990年にかけて急速に低下し世界一の長寿国となった.脳卒中死亡率の低下には,その罹患率の低下が大きく貢献した.これには,国民の血圧水準の低下が大きく寄与している.このような国民の血圧水準の推移は,久山町や秋田・大阪の疫学調査によっても認められている.
今後の血圧推移に影響を与える因子として,日本では高齢者人口が全体の約21%と超高齢社会を迎え,75歳以上の人口も約10%となっている急速な高齢者の増加という問題がある.高血圧は加齢とともに増加し,わが国の国民健康・栄養調査(平成18年)によれば,60歳代の61%,70歳以上の72%が高血圧に罹患している.図6-2-12に示すように加齢とともに収縮期血圧は上昇し,拡張期血圧はむしろ低下傾向にある.このため脈圧の開大が著しくなる.高齢者における収縮期血圧の上昇および脈圧の開大は心血管病のリスクとして重要である.
(3)高血圧の長期予後
高血圧はさまざまな疾患のリスクとなり得るが,多くのコホート研究のメタ解析では,若年者から高齢者にわたり,血圧値が高いほど循環器疾患罹患・死亡リスクが高いことが明らかとなっている.国民の代表集団約1万人を14年間追跡したNIPPON DATA80においても,年齢区分を30~64歳,65~74歳,75歳以上に分けて循環器疾患死亡リスクを検討した男性の成績では,高齢群の相対リスクは若年群よりも小さいが,血圧区分が高くなるほど循環器疾患死亡リスクが高くなることを認めている(図6-2-13).さらに,血圧値が高いほど若年者から高齢者に至るまで総死亡率が高くなることが日本のコホートを統合した大規模メタ解析で明らかになった(図6-2-14).
高血圧は脳卒中との関連性が強く,わが国では,依然として脳卒中死亡率・罹患率が虚血性心疾患あるいは心筋梗塞死亡率・罹患率より高い.しかし,脳卒中死亡率が減少したことにより心疾患全体の死亡率は脳卒中死亡率よりもやや高くなっている.高血圧と脳卒中罹患率・死亡率との関係には段階的な正の関連がある.脳卒中の病型別では,脳出血が脳梗塞よりも血圧との関連は強いが,段階的な正の関連は同じである.久山町研究の追跡調査では,血圧と脳卒中の関連は段階的な強い正の関連がみられている(図6-2-15).また,ラクナ梗塞においても米国高血圧合同委員会第Ⅵ次報告(JNC-Ⅵ)による血圧区分とよく相関した.JNC-Ⅵ血圧区分と脳卒中死亡の強い関連性はNIPPON DATA80においても明瞭に示されている.日本内外の追跡調査結果をまとめて示した血圧と脳卒中罹患・死亡率の相対危険度が『健康日本21』の資料にも示されている.それによれば収縮期血圧10 mmHgの上昇は,男性では約20%,女性では約15%,脳卒中罹患・死亡の危険度を高める.脳卒中・心筋梗塞罹患率を調査したWHOの共同研究(MONICA)では,脳卒中発症患者35~64歳の28日以内の致命率はほぼ30%前後であるが,わが国の1990年頃の脳卒中登録成績では,全年齢調整の28日以内の致命率は15%程度であった.久山町の1970年代初頭から1980年代初頭にかけての40歳以上の初発脳卒中患者の1年以内の死亡割合が40%で28日以内の死亡割合は,男性25%,女性22%であったことを考えると致命率の改善がみられている.脳卒中発症1年後の日常生活動作の低下による要介助者の割合は29~45%程度で寝たきり予防の観点から脳卒中予防対策としての高血圧対策はきわめて重要である.
心疾患に関しても同様である.男性では収縮期血圧が10 mmHg上昇すると,冠動脈疾患罹患・死亡の危険度は約15%増加する.欧米の疫学研究では,高血圧は心不全の基礎疾患として最も頻度が高いことが示されているがわが国における登録研究でも同様の結果が示されている.また欧米の大規模臨床試験の成績では降圧治療により高血圧患者における心不全発症率が減少することが明らかにされている.高血圧による心不全は,拡張機能障害が心不全のおもな病態である.高血圧性心疾患患者では心肥大・心筋線維化によって早期から左室拡張機能の障害が認められる.したがって持続的な降圧治療は心肥大・心筋線維化を軽減し,拡張機能障害を改善することが期待される.疫学研究により心肥大は高血圧患者の予後を規定する独立の要因の1つであることが明らかにされており,心肥大を合併する患者では,死亡率および冠動脈疾患による心事故や心不全の発症率が高い.高血圧治療によって心肥大が退縮した患者群では,退縮がみられなかった患者群に比して心事故や突然死の発生率が減少する.心肥大の刺激として収縮期高血圧および拡張期高血圧がともに関与するので,治療に際しては両者のコントロールが必要である.
高血圧は腎臓に対して機能的あるいは器質的な変化を早期から多少なりとも及ぼしている.一方,腎障害は高血圧の原因にもなり得る.高血圧と腎臓は相互に密接に関連し,高血圧は腎機能障害を悪化させ,腎機能障害が起こると高血圧がさらに増悪するという悪循環を形成する.また,血圧管理は腎障害を軽減しその後の心血管リスクの低下を促す.わが国においても,久山町研究,NIPPON DATA90などのコホート研究において,推算糸球体濾過量の低い人ほど循環器疾患発症・死亡リスクが高いことが示されている.またNIPPON DATA80では蛋白尿陽性者は循環器疾患死亡リスクが高いことが認められている.
(4)長期降圧療法と予後
高血圧治療の目的は,高血圧の持続によってもたらされる心臓と血管の障害に基づく心血管病の発症と,それらによる機能の障害や死亡を抑制し,すでに心血管病を発症している場合にはその進展,再発を抑制して死亡を減少させることである.そして高血圧患者が健常者と変わらない充実した日常生活を送れるように支援することである.このように考えれば,個々の高血圧患者の心血管病発症リスクが大きければ,高血圧治療によって得られる効果も大きい.過去に諸外国においてプラセボを対照に行われた大規模無作為化比較試験の結果から,降圧薬治療は高血圧患者にとって多くの有益な効果をもたらすことが明らかにされた.すなわち,降圧薬治療は心血管病の発症率と死亡率を明らかに低下させる.これまでに海外で行われた臨床試験をまとめて解析した成績によると,収縮期血圧10~20 mmHg,拡張期血圧5~10 mmHgの低下により相対リスクは脳卒中で30~40%,虚血性心疾患で15~20%それぞれ減少することが明らかにされている(Staessen ら, 2000).
わが国の脳卒中と虚血性心疾患の発症率は欧米と異なるので,上記の成績をそのままわが国に当てはめることはできないが,血圧レベルの高い高血圧患者ほど,また高齢者ほど降圧薬治療の有用性が高いことは人種を問わないと思われる.『健康日本21』では,わが国の疫学調査研究をまとめ,国民の血圧水準の低下による脳卒中および虚血性心疾患罹患率の低下の期待値を算出した.それによれば,国民の収縮期血圧水準2 mmHgの低下で,脳卒中罹患率は6.4%の低下が,虚血性心疾患罹患率は5.4%の低下が期待できる.
また,脳卒中死亡者数は9000人程度減少し,日常生活動作(activities of daily living:ADL)低下者は3500人程度減少する.虚血性心疾患死亡者数は約4000人減少し,循環器疾患全体の死亡者は約21000人減少すると推察される.これらの試験では血圧レベルが高いほど,また高齢者ほど降圧薬治療による絶対リスクの減少が大きいことが示されている.また,収縮期高血圧を対象とした試験の解析でも,収縮期血圧の10 mmHg程度の低下で脳卒中は30%,虚血性心疾患は二十数%それぞれ減少することが示されている. 高齢者では比較的短期間の治療で効果が明らかになるのに対し,若年者や成・壮年者では長期間にわたる高血圧の治療が必要であることを認識すべきである.わが国では欧米とは異なり,虚血性心疾患よりも脳卒中の発症頻度が数倍高いことから,降圧薬治療の有用性はより高いことが予想される.また,降圧薬治療による心血管病抑制効果をメタ解析した成績では治療によるリスクの減少は男女で差がないことが示されている.さらに大規模臨床試験のメタ解析において,降圧薬の種類よりも降圧の程度が最も予後改善に寄与していることが示されている.
(5)高齢者高血圧の長期予後
高齢者においても,青壮年者における関連よりも弱くなるが血圧と脳卒中の関連は認められる.久山町研究では,80歳以上は60~79歳と比較してJNC-Ⅵ血圧分類との関連は弱くなるが,欧米および日本の多くのコホートを統合したメタ解析では弱くなっても明瞭に関連が示されている.わが国の久山町研究や61の前向き研究から得られた心血管疾患の既往がない約100万人を対象としたメタ解析で,血圧上昇と心血管リスク増大に正相関が認められ,高齢になるに従い勾配はゆるやかになるものの絶対リスクは増大し80歳代でも正相関を示した.
わが国における19年間の追跡研究であるNIPPON DATA80でも,75歳以上で血圧上昇と心血管死のリスク増大は正相関した.これらの事実に基づき,高齢者高血圧の基準は一般成人と同じであると考えられる.一方,高血圧による心血管リスクや死亡率の増加について閾値があるとする疫学研究もある.死亡率に対する血圧値の閾値を算出したFramigham研究再解析では,加齢に伴い閾値が上昇し,前期高齢者では男性で約160 mmHg,女性で約170 mmHgであった.久山町研究では,60〜79歳では140 mmHg以上でリスクが有意に増大し,80歳以上では180 mmHg以上にその閾値が上昇する. さらに,85歳以上の地域住民を対象とした前向き研究では,Vantaa 85 plusとLeiden 85 plusというまったく別の2つの集団で行われた試験において,収縮期血圧140 mmHg未満の群と比較して160 mmHg以上の群の方が予後良好であった.基本的には高齢者においても血圧が低いほど心血管リスクは低いといえるが,研究対象や解析事項によって結果が異なることは高齢者のなかでも年齢や病態に応じて高血圧の疾患としての意義が異なる可能性を示す.プラセボを対照とした無作為化比較試験で,降圧薬の心血管病発症抑制効果が示されている. 60歳ないし70歳以上の高齢者高血圧を対象として利尿薬やβ遮断薬を用いたEWPHE,STOP Hypertension,MRCⅡなどの試験やARBを用いたSCOPEなどの試験がある.高齢者に多い収縮期高血圧に対しては利尿薬を用いたSHEP,Ca拮抗薬を用いたSyst Eur,Syst China,STONEなどがある.試験の多くは収縮期血圧160 mmHg以上を対象とし,到達した収縮期血圧は大部分が140~150 mmHgである.60歳以上の高齢者高血圧治療に対する9つの主要大規模臨床試験のメタ解析によると,降圧薬治療により全死亡12%,脳卒中死36%,虚血性心疾患死亡25%といずれも有意な抑制が認められ,脳血管障害発症35%,虚血性心疾患発症は15%の有意な抑制がみられている.
さらに65歳未満と以上とで降圧療法の心血管イベント抑制効果の差違についてメタ解析を行ったBPLTTCのサブ解析では,両群に差違はなく,降圧度と心血管イベント抑制効果に非常に強い相関が認められた(図6-2-16).80歳以上の高齢者での高血圧患者(平均血圧173/91 mmHg)を対象としたHYVET(Beckett ら, 2008)では,利尿薬(降圧不十分な場合ACE阻害薬を追加)を用いて150/80 mmHg未満を目指した治療の結果,脳卒中30%ならびに総死亡21%,心不全64%,心血管イベント34%の有意な減少を認めた.2年目の到達血圧は144/78 mmHgであった.
以上,高齢者においても年齢によらず積極的に降圧療法を行うことが勧められる.ただし,HYVETを含め80歳以上で140 mmHg未満まで降圧することの有用性や高齢者のⅠ度高血圧に対して降圧治療を行うことの有用性を明確に示唆するエビデンスはなく,注意深い降圧が必要である.
(1)降圧薬治療の基本
高血圧治療の目的は高血圧による心血管病の発症,進展,再発を抑制して死亡を減少させ,高血圧患者が充実した日常生活を送れるように支援することである.
治療の対象はすべての高血圧患者(血圧140/90 mmHg以上)であり,糖尿病や慢性腎臓病(CKD),心筋梗塞後患者では130/80 mmHg以上が治療の対象となる.降圧目標は若年者・中年者では130/85 mmHg未満とする.糖尿病やCKD,心筋梗塞後患者では130/80 mmHg未満とし,脳血管障害患者,高齢者では140/90 mmHg未満とする.
降圧治療は,生活習慣の修正(非薬物療法)(第1段階)と降圧薬治療(第2段階)がある(図6-2-17).
初診時にまず血圧測定,病歴聴取,身体所見,尿・血液・生化学(ホルモン)所見などを参考に二次性高血圧を除外する.同時に血圧以外の動脈硬化症の危険因子,高血圧臓器障害,心血管病の有無,合併症などの評価を行い,患者のリスクの層別化を行う.さらに,生活習慣の修正をすべての患者に指導し,徹底する.この上で,図6-2-17のとおり,層別化されたリスクの程度に従い,降圧目標達成のために必要に応じ,降圧薬治療を適切な時期から開始する.
(2)高血圧の非薬物療法−生活習慣の修正−(表6-2-11)
高血圧の発症には遺伝素因と環境要因が関与しており,環境要因は主として社会の文明化に伴う生活習慣の変化によるものである.
生活習慣の修正は食塩摂取量の制限,減量,運動療法,アルコール摂取量の制限,果物や野菜の摂取の促進,飽和脂肪酸や総脂肪量摂取の制限,禁煙などがある.それ自体で降圧効果が認められる.さらに,降圧薬の作用を増強させる効果があり,降圧薬減量の一助となりうる.高血圧の予防のためにはすべての人が生活習慣の修正を心がけるべきである.
(3)降圧薬療法
a.降圧薬療法の基本
血圧のレベルが高くなるほど,生活習慣の改善のみでは目標降圧レベルに達することは困難であり,降圧薬による治療が必要となる.降圧薬で血圧を下降させることにより,心血管病の発症を予防できる.
現在,使用されているおもな降圧薬はその作用機序により表6-2-12のとおり,5種類に分類される.降圧薬の心血管病抑止効果の大部分はその種類よりも降圧度によって規定される.
降圧薬の使い方の基本は以下の通りである.①単剤もしくは併用使用を目的に最初に投与すべき降圧薬は,Ca拮抗薬,アンジオテンシンⅡ受容体拮抗薬(ARB),アンジオテンシン変換酵素(ACE)阻害薬,利尿薬,β遮断薬の中から選択する.②積極的な適応(表6-2-12)や禁忌もしくは慎重使用となる病態(表6-2-13)や合併症の有無に応じて,適切な降圧薬を選択する.③降圧薬は,1日1回投与を原則とするが,24時間にわたって降圧することがより重要であり,1日2回の分割投与が好ましいこともある.④降圧目標を達成するためには,多くの場合,2,3剤の併用が必要となる.その際,少量利尿薬を積極的に併用すべきである.⑤2剤の併用としてレニン-アンジオテンシン(RA)系阻害薬(ARBあるいはACE阻害薬)+Ca拮抗薬,RA系阻害薬+利尿薬,Ca拮抗薬+利尿薬,Ca拮抗薬+β遮断薬が推奨される.⑥合剤により,処方を単純化することはアドヒアランス(治療継続)の改善,血圧コントロールの改善に有用である.⑦特に,高齢者など,一般には降圧が望ましいが,Ⅲ度高血圧や多重危険因子保有など高リスク症例では数週間以内に速やかに降圧目標を達成することが望ましい.
b.各種降圧薬のおもな特徴と副作用
積極的な適応(表6-2-12)と禁忌・慎重使用(表6-2-13)に加え,以下の特徴を有する.
1)Ca拮抗薬:
血管平滑筋の細胞外から内へ入るCa2+を抑制して,血管拡張をもたらす.重篤な副作用がなく,利尿薬についで安価であり,わが国で最も頻用されている降圧薬.副作用として,顔面紅潮,頭痛,動悸,上下肢浮腫,便秘,歯肉増生,ジルチアゼムで徐脈,房室ブロックなどがある.
2)アンジオテンシン受容体拮抗薬(ARB):
アンジオテンシン(AT)Ⅱの作用をAT1受容体レベルで抑える.末梢血管拡張,アルドステロン分泌抑制,ノルアドレナリン放出抑制などを介し降圧する.副作用が少なく,Ca拮抗薬についで多用されている.
3)ACE阻害薬:
ACEを阻害して,アンジオテンシンⅡ産生を減少させ,同時にキニナーゼⅡ阻害によりブラジキニン,PGE2,NOなどの増加を介し降圧する.ARBとともに心・腎の保護効果を有する.腎保護には腎の輸出細動脈拡張,糸球体内圧低下作用,尿蛋白減少作用などが関与する.副作用には,ブラジキニン増加による咳が20〜30%にみられる.まれに,血管神経性浮腫による呼吸困難を生じる.
4)利尿薬:
腎尿細管においてNaと水の再吸収を抑制して,循環血液量を減少させて降圧効果をもたらす.比較的安価である.副作用として,低カリウム血症,痛風,耐糖能異常などがある. K保持性利尿薬(アルドステロン拮抗薬)では高カリウム血症,女性化乳房などの副作用がある.
5)β遮断薬:
作用機序には不明な点が多いが,心拍出量,レニン産生分泌低下,中枢作用などが考えられている.副作用では気管支喘息誘発,徐脈,房室ブロックなどがある.
(4)高血圧緊急症の治療
高血圧緊急症(hypertensive crisis,hypertensive emergency)は単に,血圧が異常に高いだけの状態ではなく,血圧の高度の上昇(多くは180/120 mmHg以上)によって,脳,心,腎,大血管などの標的臓器に急性の障害が生じ進行している病態である.迅速に診断し,直ちに治療を始めなければならない.緊急症には高血圧性脳症,急性大動脈解離を合併した高血圧,肺水腫を伴う高血圧性左心不全,高度の高血圧を伴う急性冠症候群(急性心筋梗塞,不安定狭心症),褐色細胞腫クリーゼ,子癇などが該当する(表6-2-14).高度の高血圧であるが,臓器障害の急速な進行がない場合は高血圧切迫症(hypertensive urgency)として扱う.なお,緊急症であるかどうかは血圧のレベルだけで判断すべきでない.血圧が異常高値であっても,急性あるいは進行性の臓器障害がなければ緊急降圧の対象ではなく,子癇や急性糸球体腎炎による高血圧性脳症や大動脈解離などでは血圧が異常高値でなくても緊急降圧の対象となる.
緊急症では,入院治療と経静脈的な降圧が原則である.観血的に血圧をモニターすることが望ましい.臓器障害や血管病変を有しているため必要以上の急速で過剰な降圧は臓器灌流圧の低下により脳梗塞,皮質黒内障,心筋梗塞,腎機能障害の進行などの虚血性障害を引き起こす可能性が高い.
一般的な降圧目標は,はじめの1時間以内では平均血圧で25%以上は降圧させず,次の2〜6時間では160/100〜110 mmHgを目標とする. 初期降圧目標に達したら,内服薬を開始し,注射薬は用量を漸減しながら中止する. 切迫症では高血圧の病歴が長く慢性の臓器障害もみられる場合が多い.したがって,臓器血流の自動調節能の下限が高いことが想定される.そのため,降圧治療は診断後数時間以内には開始すべきであるが,その後24時間から48時間かけて比較的緩徐に160 / 100 mmHg程度まで降圧をはかる.切迫症では内服薬によってコントロールできる場合が多い.Ca拮抗薬のニフェジピンカプセル内容物の投与やニカルジピン注射薬のワンショット静注は,過度の降圧や反射性頻脈をきたすことがあるため行わない.作用発現が比較的速いCa拮抗薬(短時間作用薬や中間型作用薬),ACE阻害薬,αβ遮断薬のラベタロール,β遮断薬の内服,また,病態によって利尿薬の併用など行う.
(5)合併症を伴った高血圧の治療
a.脳血管障害(表6-2-15)
脳血管障害超急性期(発症3時間以内)から急性期(発症1〜2週間以内)では,臨床病型により降圧対象,降圧目標が異なる.脳梗塞超急性期で血栓溶解療法施行患者では,治療中や治療後を含む24時間の血圧を180/105 mmHg未満にコントロールする.血栓溶解療法の適応とならない脳梗塞では,収縮期血圧>220 mmHg,または拡張期血圧>120 mmHg,脳出血では,収縮期血圧>180 mmHg,または平均血圧>130 mmHgの場合に降圧対象となる.降圧の程度は,脳梗塞では前値の85〜90%,脳出血では前値の80%をめやすとする.
脳血管障害慢性期(発症1カ月以降)では,降圧最終目標(治療開始1〜3カ月)は140/90 mmHg未満とする.緩徐な降圧がきわめて重要であり,臨床病型(脳出血,ラクナ梗塞など),脳主幹動脈狭窄,閉塞の有無,脳循環不全症状の有無に留意する.両側頸動脈高度狭窄,脳主幹動脈閉塞の場合には特に下げ過ぎに注意する必要がある.ラクナ梗塞や脳出血では140/90 mmHgよりさらに低い降圧目標とする. 無症候性脳梗塞や無症候性脳出血を合併する高血圧患者の降圧療法における目標血圧値や有用な降圧薬は,脳血管障害慢性期のそれに準ずる.
b.心疾患
ⅰ)冠動脈疾患
冠動脈疾患では注意深く十分降圧することが重要である.原則として,140/90 mmHg未満を降圧目標とする.心筋梗塞後の患者では,β遮断薬,RA系阻害薬(ACE阻害薬,ARB),アルドステロン拮抗薬が死亡率を減少させ予後を改善する.慎重に130/80 mmHg未満まで降圧することが望ましい.器質的冠動脈狭窄を有し,狭心症を合併する高血圧では,長時間作用型Ca拮抗薬や内因性交感神経刺激作用のないβ遮断薬がよい適応となる.冠攣縮性狭心症ではCa拮抗薬が適応.
ⅱ)心不全
心不全に対して,降圧薬は必ずしも降圧だけが目的ではなく,心不全患者のQOLや予後を改善するために用いられる.RA系阻害薬+β遮断薬+利尿薬の併用療法が心不全治療の標準的治療法であり,死亡率を減少させ予後を改善する.ただし,RA系阻害薬やβ遮断薬の導入にあたっては,心不全の悪化,低血圧,徐脈(β遮断薬),腎機能低下などに注意しながら,少量から緩徐に注意深く漸増する.アルドステロン拮抗薬は標準的治療を受けている重症心不全患者の予後をさらに改善させる.心不全を合併する高血圧症では,十分な降圧治療が重要であり,降圧が不十分な場合には長時間作用型Ca拮抗薬を追加する.
ⅲ)心肥大
心肥大が退縮すると予後が改善することが示唆されている.どの降圧薬でも持続的かつ十分な降圧により肥大を退縮させる.特にRA系阻害薬,長時間作用型Ca拮抗薬は肥大退縮効果にすぐれている.
ⅳ)心房細動
(予防) 高血圧は心房細動発症の危険因子である.十分な降圧により心房細動発症が予防されることが示唆されている.
c.腎疾患(図6-2-18)
慢性腎臓病(CKD)患者は,心血管事故のリスクが高く,早期発見がきわめて重要である.早期発見のため,全高血圧患者で検尿とeGFR(推算GFR)の算出を行う.アルブミン尿は腎障害の進展と心血管疾患の発症に密接に関連し,アルブミン尿の減少は心腎同時保護に重要である.
降圧療法の三原則は,①降圧目標の達成,②レニン-アンジオテンシン系の抑制,③尿アルブミン,尿蛋白の減少・正常化である.
生活習慣では,禁煙・食塩制限・適正体重の維持,および腎機能に応じた蛋白制限を行う.運動は腎機能に応じた指導を行う.
降圧目標は130/80 mmHg未満とする.
糖尿病合併CKD患者,軽度以上の蛋白尿を呈する糖尿病非合併CKD患者では,RAS阻害薬を第一選択薬とする.血清クレアチニン2.0 mg/dL以上では少量から使用し,血清クレアチニン値やK値の上昇に注意する.正常蛋白尿の糖尿病非合併CKD患者では高圧薬の種類を問わない.
多くの場合,利尿薬やCa拮抗薬との他剤併用療法が必要となる.利尿薬の使用においては,GFRが30 mL/分 /1.73 m2以上ではサイアザイド系利尿薬,30未満ではループ利尿薬を用いる.
透析患者の降圧薬の選択時には,薬物代謝,排泄経路,透析性に注意する.
d.糖尿病(図6-2-19)
糖尿病合併高血圧の降圧目標は130/80 mmHg未満とする.
糖尿病合併高血圧患者における降圧薬選択に際しては,糖・脂質代謝への影響と合併症予防効果の両面より,ACE阻害薬,ARBが第一選択薬として推奨され,血圧管理にCa拮抗薬,少量のサイアザイド系利尿薬が併用される.また,労作性狭心症や陳旧性心筋梗塞合併例では,β遮断薬も心保護作用を有し,血圧管理に使用可能である.
e.高齢者高血圧(図6-2-20)
高齢者高血圧の特徴は,①収縮期血圧の増加と脈圧の開大,②血圧の動揺性,③起立性低血圧や食後血圧降下例の増加,④血圧日内変動で夜間非降圧型non-dipperの増加,⑤早朝の昇圧(morning surge),⑥白衣高血圧の増加,⑦聴診間隙(Korothoff音の欠失)のみられる症例の存在,⑧偽性高血圧の存在(直接法と解離して,マンシェット法では見掛け上高く測定される)などがある.
高齢者でも最終降圧目標達成のために積極的な治療を行う.いずれの年齢層でも140/90 mmHg未満の降圧により予後改善が期待される.65歳未満から治療中の患者において65歳になって降圧を緩める必要はない.降圧スピードに関しては,副作用の発現に留意し,緩徐な降圧を心がける.非薬物療法は,QOLに配慮して個々に方針を決定する.降圧薬治療はCa拮抗薬,ARB,ACE阻害薬,少量の利尿薬を第一選択薬とする.一般に常用量の1/2量から開始する.降圧効果不十分な場合はこれらの併用を行う.合併症を伴う場合は,個々の症例に最も適した降圧薬を選択する.臓器障害に注意し,QOLに配慮しながら慎重に降圧する.[島本和明・苅尾七臣・檜垣實男・大蔵隆文・大石 充・楽木宏実・梅村 敏]
■文献
International Consortium for Blood Pressure Genome-Wide Association Studies, et al: Nature 478: 103-109, 2011.
Symplicity HTN-2 Investigators. Renal sympathetic denervation in patients with treatment-resistant hypertension (The Symplicity HTN-2 Trial): a randomised controlled trial. Lancet, 376: 1903-1909, 2010.
Tabara Y, Kohara K, et al: Common variants in the ATP2B1 gene are associated with susceptibility to hypertension: the Japanese Millennium Genome Project. Hypertension, 56: 973-980, 2010.
苅尾七臣:仮面高血圧–病態と治療,日本内科学会雑誌,96: 79-85, 2007.
Kario K, et al: Morning surge in blood pressure as a predictor of silent and clinical cerebrovascular disease in elderly hypertensives: a prospective study. Circulation, 107: 1401-1406, 2003.
日本高血圧学会治療ガイドライン作成委員会:高血圧治療ガイドライン2009(JSH2009),日本高血圧学会,ライフサイエンス出版,東京,2009.
Asayama K, et al: Stroke risk and antihypertensive drug treatment in the general population: Japan arteriosclerosis longitudinal study. J Hypertens, 27: 357-364, 2007.
Boggia J, et al: Prognostic accuracy of day versus night ambulatory blood pressure: a cohort study. Lancet, 370: 1219-1229, 2007.
Gunau A, et al: Patterns of left ventricular hypertrophy and geometric remodeling in essential hypertension. J Am Coll Cardiol, 19: 1550-1558,1992.
Beckett NS, Peters R, et al: Treatment of hypertension in patients 80 years of age or older. N Engl J Med, 358:1887-1898, 2008.
Dzau VJ, Antman EM, et al: The cardiovascular disease continuum validated: clinical evidence of improved patient outcomes: part I: Pathophysiology and clinical trial evidence (risk factors through stable coronary artery disease). Circulation, 114: 2850-2870, 2006.
Staessen JA, Gasowski J, et al: Risks of untreated and treated isolated systolic hypertension in the elderly: meta-analysis of outcome trials. Lancet, 355: 865-872, 2000.
日本高血圧学会高血圧治療ガイドライン作成委員会:高血圧治療ガイドライン2009(JSH2009),ライフサイエンス出版,東京,2009.

表6-2-1
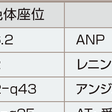
表6-2-2

表6-2-3

表6-2-4

表6-2-5

表6-2-6

表6-2-7

表6-2-8

表6-2-9

表6-2-10

表6-2-11
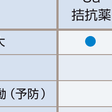
表6-2-12
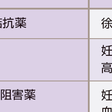
表6-2-13
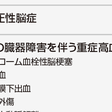
表6-2-14

表6-2-15

図6-2-1
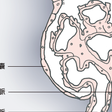
図6-2-2
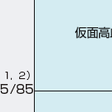
図6-2-3
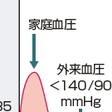
図6-2-4
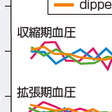
図6-2-5
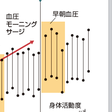
図6-2-6
図6-2-7

図6-2-10

図6-2-11
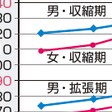
図6-2-12
図6-2-13
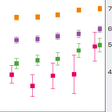
図6-2-14

図6-2-15
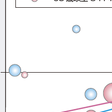
図6-2-16

図6-2-17
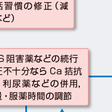
図6-2-18

図6-2-19

図6-2-20
出典 内科学 第10版内科学 第10版について 情報

