内科学 第10版 「血清蛋白質異常」の解説
血清蛋白質異常(蛋白質・アミノ酸代謝異常)
総蛋白質(total protein:TP)
血清の総蛋白の基準値は一般に6.5~8.0 g/dLであり,性差はほとんど認めない.ただし新生児や幼児は成人より1~1.5 g/dL程度,60歳以上は0.5 g/dL程度低値である.
a.プロテオームとプロテオミクス
ヒトゲノム解読プロジェクトですべての蛋白をコードする遺伝子は解明された.それに基づいて現在は,発現している蛋白のすべて(-ome)を系統的・網羅的に解析することが行われつつある.これを“蛋白のすべて”という意味でプロテオーム(proteome)といい,その学問は-micsと語尾をつけて,プロテオミクス(proteomics)とよばれる.プロテオミクスでは,生体内でつくられる蛋白質の構造と機能を明らかにし(第1段階),それらのネットワークを解明し(第2段階),生命現象を明らかにするとともに,最終的には疾病の診断・治療,そして創薬につなげてゆくことを目指す(第3段階).なおこのプロテオミクスの発展に大きく寄与したのが田中耕一(2002年度ノーベル賞)の開発した技術(レーザーによる蛋白質のイオン化質量分析法)である.今後,病因・病態の解明,診断と治療などに大きく寄与するものと期待されている.
b.血清蛋白質の電気泳動による分画
臨床医学では血清(あるいは血漿)の蛋白は電気泳動法で分画してそのパターンから分画の濃度を半定量して評価することが多い(図13-3-6).これにより,アルブミンの減少や,ガンマグロブリンの増加などをパターンとして認識し得る.すなわち陽極側から,アルブミン,α1-,α2-,β-,ガンマグロブリンの順番に分けられる.このうちガンマグロブリン分画の主成分は免疫グロブリン(immunoglobulin)であり,これにはIgG,IgA,IgM,IgD,IgEなどが属する.ガンマグロブリン分画は免疫グロブリンの多寡を反映し,多クローン性の増加の場合にはブロードな,単クローン性の増加の場合にはシャープな峰となる.前者は肝硬変や,慢性炎症で,後者は多発性骨髄腫で観察される(図13-3-7).ネフローゼ症候群の場合には腎糸球体からアルブミンが漏出し,低アルブミン血症となる一方,分子量の大きいα2-マクログロブリン,IgM,β-リポ蛋白,フィブリノゲンなどは漏出せず,α2からβ領域が増加してくる.
肝機能が中等度以上低下した肝疾患では,アルブミンが減少する.特に肝硬変の場合には,アルブミンの減少に加えて,ガンマグロブリン(IgG,IgA)が増加する.アルブミンの減少とガンマグロブリンの増加というパターンは,肝硬変のほかに,関節リウマチなどの膠原病や,慢性感染症などでも観察される(図13-3-7).
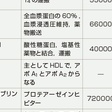
c.血清蛋白とその異常(表13-3-1)
ⅰ)アルブミン
ヒトの場合,アルブミンは全血漿蛋白の約60%を占める.また全アルブミンのうち血漿中に含まれるのは約40%で,残りの60%は組織中の細胞外に存在する.分子量66000の1本鎖の長いペプチドで,糖鎖はない.アルブミンは肝細胞で合成され,その量は成人の場合,約12 g/日にも及び,その半減期は約21日である.血中濃度が低下するのは肝硬変をはじめとする肝機能低下や,ネフローゼなど腎糸球体からの漏出,消化管からの漏出(潰瘍性大腸炎,蛋白漏出性腸炎など),火傷など皮膚からの消失などの病態でみられる(表13-3-1).生体内でのアルブミンの機能は,①血漿浸透圧の保持②生体内におけるアミノ酸の予備供給源③各種蛋白や蛋白断片,薬物のキャリアなどとして働く.浸透圧に関しては,血漿の浸透圧の約80%はアルブミンに依存している.アルブミンの代謝回転は15~20 g/日と速く,分子内に1個しか含まれないトリプトファンを除き,そのほかのアミノ酸の供給源となる.またアルブミンは,各種蛋白やその断片,薬物と結合して,そのキャリアー蛋白としての機能を発揮する一方,それらの腎糸球体からの漏出の防止の役割も果たす.薬物に関しては,ワルファリン,アスピリンなどは血中に入ると,アルブミンと結合して体内を循環している.薬剤としての作用を発揮するのは,遊離型の薬剤である.したがって,肝疾患やネフローゼなどで血中のアルブミン濃度が下がると,遊離型の薬物が増え,薬物の効果が強くなる.ワルファリン投与中にアスピリンを併用すると,アスピリンがワルファリンのアルブミンの結合を阻害し,結果的に遊離型ワルファリンの血中濃度が上昇し,抗凝固作用が増強されるなど,薬物運搬体としてのアルブミンの機能は,後述するあと1つの血清薬物運搬蛋白のα1酸性糖蛋白(α1-acid glycoprotein)とならんで重要である.
ⅱ)血清グロブリン
グロブリンは図13-3-6に示したように電気泳動で,α1-グロブリン,α2-グロブリン,β-グロブリン,ガンマグロブリン分画に含まれる種々の機能を有した多種類の蛋白からなる.
1)トランスサイレチン(transthyretin:TTR):
トランスサイレチンは電気泳動でアルブミンよりさらに陽極側に泳動されるため,プレアルブミンともよばれる.TTRの機能は,名前のとおりサイロキシン(T4)と結合し,これを運搬することである.そのほかにレチノール(ビタミンA)結合蛋白とも結合し,複合体を形成する.TTRの分子異常症はアミロイドとなって組織に沈着し,家族性アミロイドーシスの原因となる.TTRは甲状腺機能亢進症やネフローゼ症候群で増加し,肝障害,蛋白摂取不足,炎症,広範な組織傷害などで低下する(表13-3-1).
2)トランスフェリン(transferrin:Tf):
トランスフェリンは鉄の輸送蛋白である.すなわち腸管から吸収された鉄,赤血球の破壊(正常で1日約2000億個)に伴って放出された鉄はTfと結合し輸送され,骨髄細胞,その他の生体内細胞に運搬され,Tf受容体から細胞内に取り込まれる.血清Tfの濃度の異常は表13-3-1
に示したような病態と関係する.
3)ハプトグロビン(haptoglobin:Hp):
ハプトグロビンは肝細胞で合成されるヘモグロビン(hemoglobin:Hb)のキャリアー蛋白である.すなわち溶血により赤血球の外に遊離したヘモグロビンと結合し,分子量を大きくすることで,腎糸球体からのヘモグロビンの漏出を阻止する.Hbが糸球体から濾過されると,尿細管に沈着し,結果として尿細管を障害するので,HpはHbの尿への漏出と腎尿細管障害を防止する機能を有している.Hp-Hb複合体は肝臓へ運ばれ,再利用される.
Hpは急性反応性蛋白であり,炎症時に血中濃度は増加するが,不適合輸血による溶血や発作性夜間ヘモグロビン尿症(paroxysmal nocturnal hemoglobinuria:PNH),自己免疫性溶血性貧血(autoimmune hemolytic anemia:AIHA)などでは消費されて血中濃度が減少する(表13-3-1).
4) α1-酸性糖蛋白(α1-acid glycoprotein:AAG):
AAGは生理的機能には不明の点が多いが,塩基性の蛋白や薬剤と結合して運搬する作用がある.急性反応性蛋白の一種でもある.
5) α1-アンチトリプシン(α1-antitrypsin):
電気泳動上α1分画に泳動されるプロテアーゼインヒビターである.主として肝臓で合成されるが,血小板,マスト細胞,好中球にも含まれる.トリプシン,キモトリプシン,エラスターゼ,プラスミンなどを阻害する.諸性質は表13-3-1
のとおり.
6) α2-マクログロブリン(α2-macroglobulin:α2-M):
α2-Mは分子量725000の高分子の蛋白である.主として肝細胞で合成される.主要な働きは,血中のプロテアーゼの活性阻害である.炎症や血栓形成時に,病巣から逸脱してくるプロテアーゼと結合し,反応の拡大を防ぐ働きがある.形成されたα2-M-プロテアーゼ複合体はマクロファージ系細胞の貪食を受け,速やかに循環血中から除去される.
7)レチノール結合蛋白(retinol binding protein:RBP):
RBPは血中レチノール(ビタミンA)の特異的な輸送蛋白である.血中ターンオーバーが速いので,最近は栄養状態の評価にも使用されている.糸球体で濾過されたRBPは尿細管で再吸収され,異化される.腎不全では,糸球体濾過能の低下のため,血中濃度が上昇し,腎尿細管障害では,尿中排泄が増加する.最近,RBPがインスリン抵抗性を助長し,2
型糖尿病の病態と関係することが判明してきた.
8) β2-ミクログロブリン(β2-m):
β2-mは文字どおり,分子量が11800の小分子の蛋白である.リンパ球をはじめ種々の蛋白で合成される.特に増殖しつつあるリンパ球や,悪性腫瘍が盛んに産生するので,一種の腫瘍マーカーとしての側面を有する.β2-mも尿細管で再吸収される蛋白であるので,腎尿細管性アシドーシス(renal tubular acidosis)など尿細管障害のとき,尿中に増加してくる.
9)セルロプラスミン(seruloplasmin):
セルロプラスミンは血清中の銅結合蛋白で,血清中の銅の90%は本蛋白質と結合している.銅のキャリアー蛋白として働くほか,O2-ラジカルのスカベンジャーとして働き,血中で重要な抗酸化作用を発揮している.
d.急性反応性蛋白(acute phase reactant)
細菌感染症,心筋梗塞など生体蛋白の崩壊時など,生体内で炎症を伴う病態の急性期に,血中に一過性に増加してくる蛋白を急性反応性蛋白という.これには,CRP(C-reactive protein),α1-酸性糖蛋白,α1-アンチトリプシン,ハプトグロビン,セルロプラスミン,フィブリノゲンなどが含まれる(図13-3-8).これらの蛋白はIL-6,TNFα,IL-1などの作用で,肝臓で合成される.
e.栄養アセスメント蛋白
栄養の評価(アセスメント)は健康状態の把握,患者の診療(入退院の時期決定,治療方針決定など)で重要である.これまでその客観的指標としては,アルブミンが使われてきたが,アルブミンは血中半減期が約20日と長いため,リアルタイム,かつダイナミックに個々人の栄養状態を把握するには不適切であることから,もっと血中半減期が短い蛋白(rapid turnover protein)が指標として使われるようになってきた.
それらの蛋白は表13-3-2のような蛋白であり,臨床では現在栄養サポートチームがこのような蛋白を評価しつつ,治療方針の決定に利用する傾向にある.[丸山征郎]
■文献
Gabby C, Kushner I: Mechanism of disease: acute-phase proteins and other systemic responses to inflammation. N Engl J Med, 340: 448-454, 1999.
日本臨牀 増刊号.血液・尿化学検査,免疫学的検査,第6版(1),Ⅲ.生化学的検査(1),日本臨牀社,大阪,2005.
出典 内科学 第10版内科学 第10版について 情報