内科学 第10版 の解説
血管の収縮弛緩と血圧調節機構(心血管代謝と機能)
(1)血圧調節機構
神経性調節機序としては,昇圧に働く交感神経を介した血管収縮(α受容体)・心拍数と心拍出量の増加(β1受容体)と,降圧に働く副交感神経を介した血管拡張・心拍数と心拍出量の減少,および交感神経による血管拡張(β2受容体)がある.こうした自律神経の心臓血管中枢は延髄にあり,昇圧に関係する部位(交感神経亢進)と降圧に関係する部位(交感神経抑制)とが存在する.延髄の心臓血管中枢への血圧に関する求心性入力は,頸動脈洞および大動脈弓にある圧受容器を介して反射性に調節されている(圧受容器反射).
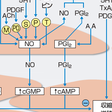
液性・局所性調節機序には,多くの脈管作動物質が関与し,オートクライン・パラクライン的に作用する(表5-2-8).なかでも重要な因子として,カテコールアミン系,レニン-アンジオテンシン系,血管内皮による調節があげられる.カテコールアミンに関しては,交感神経終末から遊離されるノルアドレナリンと副腎髄質から遊離されるノルアドレナリンとアドレナリンがある.レニン-アンジオテンシン経路から産生されるアンジオテンシンⅡは,腎臓の傍糸球体細胞で産生されるだけではなく,心臓や血管でも産生されることが明らかにされた.血管内皮は,血圧調節に重要な役割を果たし,内皮由来弛緩因子と総称される弛緩因子を産生遊離するほか,収縮因子を産生遊離することもあることが知られている(図5-2-20). 腎・体液量調節機序は,腎臓からのNa排泄機能を介して,循環血液量の調節を行っている.
(2)血管の収縮機序
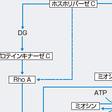
血管平滑筋の収縮は,最終的にはミオシン軽鎖がリン酸化されアクチンとの間で相互作用を生じることで惹起される(図5-2-21).このミオシン軽鎖のリン酸化は,Ca/カルモジュリン依存性に活性化されるミオシン軽鎖キナーゼにより促進され,ミオシンホスファターゼにより抑制(脱リン酸化)される二重の調節機序が働いている(エンジンのアクセル役とブレーキ役と考えると理解しやすい)(図5-2-21).従来,ミオシン軽鎖キナーゼを活性化させる役目の細胞内Ca濃度増加の役割が注目され,これに関与するL型Caチャネルを抑制するCa拮抗薬の開発に結びついた.その後,細胞内Ca濃度の増加では説明がつかない血管平滑筋の収縮が生じていることが明らかとなり,「Ca感受性」とよばれていたが,その分子機構が,低分子量G蛋白のRhoとその下流の標的分子であるRhoキナーゼによるミオシンホスファターゼの抑制であることが明らかとなった(図5-2-21).この機序は,脳血管攣縮や冠動脈攣縮などの血管平滑筋の過収縮の主因をなしていることが明らかにされている.実際の高血圧の成因には,ミオシン軽鎖キナーゼの活性化とRho/Rhoキナーゼ経路を介したミオシンホスファターゼの抑制が種々の程度に関与していると考えられるが,その詳細はまだ明らかではない.
(3)血管の弛緩機序
血管平滑筋の弛緩機序としては,上述した液性調節に加えて,血管内皮による弛緩作用が重要である.内皮由来弛緩因子として,プロスタサイクリン(PGI2),一酸化窒素(NO),内皮由来過分極因子(EDHF)が知られている.細胞内弛緩機序はそれぞれ異なり,PGI2はサイクリックAMP,NOはサイクリックGMPをセカンドメッセンジャーとしているのに対し,EDHFは血管平滑筋の細胞膜のCa活性化型Kチャネルを開口させることにより過分極を惹起して弛緩を生じる(図5-2-20).これらの機序が,最終的に,細胞内Caの減少やRhoキナーゼの抑制などを惹起し,血管平滑筋の弛緩が生じる.生体内で最も重要な弛緩刺激は,血流による内皮へのずり応力である.[下川宏明]
出典 内科学 第10版内科学 第10版について 情報