改訂新版 世界大百科事典 「オキソ酸」の意味・わかりやすい解説
オキソ酸 (オキソさん)
oxo-acid
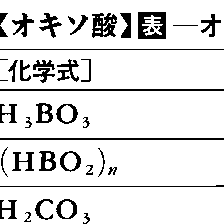
酸素を含む無機酸,すなわち酸素以外の非金属または金属原子に酸素(酸素原子の配位子名をオキソという)が配位した陰性成分を有する酸をいう。古くオキシ酸oxy-acidあるいは酸素酸などといった。水素酸に対する語。またオキソのかわりにヒドロキソOHの配位した成分を有する酸,すなわちヒドロキソ酸hydroxo-acidもオキソ酸の中に含めることもある。たとえばH[Sb(OH)6]などがそうである。通常,酸性酸化物と水とが反応して得られた形式をもっている。一般にオキソ酸の名称は,中心原子の酸化数が周期表の族番号に一致するときを標準として(Ⅶ族元素のみが例外),硫酸,硝酸,炭酸,ホウ酸などと呼び,それより酸化数の低い場合は順次,亜○○酸,次亜○○酸などと呼ぶ。Ⅶ族元素では,ハロゲンの場合酸化数Ⅴが標準で,たとえばHClO3を塩素酸,それより酸化数の高いHClO4を過塩素酸と呼び,ⅦA族のマンガンでは酸化数Ⅵが標準で,H2MnO4をマンガン酸,HMnO4を過マンガン酸と呼ぶ。したがって過○○酸の名称はⅦ族元素のオキソ酸に限られる。水の含有量の異なる酸を区別するのにはオルトorthoおよびメタmetaの接頭語を使う。たとえばオルトホウ酸,オルトケイ酸,オルトリン酸などに対してそれぞれメタ酸がある(表参照)。またオキソ酸は水溶液中で縮合してポリ酸をつくることがあるが,その縮合の程度の低いものが二硫酸H2S2O7,二リン酸H4P2O7,二クロム酸H2Cr2O7などであって,その程度の高い各種のイソポリ酸,ヘテロポリ酸も知られている。酸素原子のかわりに過酸化物イオンO22⁻(配位子名はペルオキソ)の配位した酸はペルオキソ酸と呼ばれる。ペルオキソ酸について古くは,たとえばH2S2O8を過二硫酸,H2SO5を過一硫酸,HNO4を過硝酸などと呼んだこともあったが,誤称である。
オキソ酸は一般式HnXOm+nと書けるが,mの値が小さければ酸としては弱く,大きければ強いことが経験的に知られている。たとえば酸の強さを示す電離定数で比較すると,m=0(たとえばHClO,H3BO3,H6TeO6など)ではK1≒10⁻7,m=1(たとえばHClO2,H2SO3,H3PO4など)ではK1≒10⁻2,m=2(たとえばHClO3,HNO3,H2SO4など)ではK1≒103のように順次強くなっており,m=4(たとえばHClO4,HMnO4など)ではK1≒108のようにきわめて強い酸である。またn=1以外の多塩基酸ではつねにK1:K2:K3≒1:10⁻5:10⁻10のように順次弱くなる。たとえばH3PO4ではK1=7.5×10⁻3,K2=5.9×10⁻8,K3=3.6×10⁻13である。
執筆者:中原 勝儼
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「オキソ酸」の解説
オキソ酸
オキソサン
oxoacid, oxo acid
【Ⅰ】無機化合物(oxoacid):酸素酸(oxygen acid),オキシ酸(oxyacid)ともいう.中心原子XにOが結合し,そのO原子の全部または一部にH原子が結合した化合物XOn(OH)mで,そのH原子はプロトン酸として H+ に解離し,オキソアニオンを生じる.Xは普通は非金属元素である.ある酸で解離しうるH原子が多数ある場合は,一般に第一のH原子の解離度に比べ,第二,第三のH原子の解離度はずっと小さくなる.また,数分子の同じオキソ酸が縮合してイソポリ酸を形成したり,数種類のオキソ酸が縮合してヘテロポリ酸を形成することもある.同じ中心原子Xを含むものでも,一般に多種類のオキソ酸が存在する.この場合,Xがもっとも普通の酸化数のものに,Xの元素名に酸を付けた名称をつける.たとえば,臭素酸HBrO3.ただし,Sの硫酸,Asのヒ酸,Nの硝酸などは例外である.以前はXの酸化数が,もっとも普通の酸化数より大きいときは過,小さいときは順次,亜,次亜などを付け,さらに必要な場合にオルト,メタ,ポリ酸ではピロなどを付けて区別した.それらの命名は現在もいくつかは残っている.しかし,すべての酸に適用してこの種の新名称を増やしていくのは得策ではないため,IUPAC命名法では,すべての酸に共通する水素命名法,酸命名法が提唱され,これらの接頭語は限られたものだけに使用を許すとしている.たとえば,亜硫酸H2SO3は許容された名称であるが,水素命名法では,トリオキソ硫酸(2-)二水素,酸命名法では,トリオキソ硫(Ⅳ)酸という.【Ⅱ】有機化合物(oxo acid):カルボン酸の骨格炭素鎖のC原子にO原子を置換導入したもの.つまり,カルボキシル基以外に,カルボニル基も有するアルデヒド酸やケト酸のことをいう.たとえば,
OHC-CH2CH2COOH,CH3-CO-CH2COOH
などである.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
日本大百科全書(ニッポニカ) 「オキソ酸」の意味・わかりやすい解説
オキソ酸
おきそさん
oxoacid
酸素酸ともいい、有機化学ではヒドロキシカルボン酸のことをいうこともある。形式上、酸化物と水とが結合した組成をもち、中心原子Xの周りにOHあるいはOが配位した構造[XOm-n(OH)n]をもち、一般式HnXOmをとる。たとえば硝酸と硫酸は形式的に次の反応で生ずるといえる。
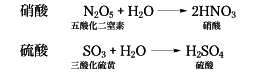
硝酸の構造は窒素原子を中心とする三角形の頂点に3個の酸素原子があり、酸素原子のうちの1個に水素原子が結合した形である。硫酸は、硫黄(いおう)原子を中心にした四面体の頂点に4個の酸素原子があり、そのうちの2個に水素原子が結合した構造と考えられている。
中心原子の酸化数によって組成と名称は異なる。塩素のオキソ酸を例にとると以下のようになる。

[岩本振武]
ブリタニカ国際大百科事典 小項目事典 「オキソ酸」の意味・わかりやすい解説
オキソ酸
オキソさん
oxygen acid; oxyacid
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「オキソ酸」の意味・わかりやすい解説
オキソ酸【オキソさん】
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「オキソ酸」の解説
オキソ酸
世界大百科事典(旧版)内のオキソ酸の言及
【酸・塩基】より
… 一酸塩基 NH3,KOH,NaOH 二酸塩基 Ca(OH)2,Ba(OH)2 三酸塩基 La(OH)3,[Co(NH3)6](OH)3なお,塩基度2以上の酸を多塩基酸,酸度2以上の塩基を多酸塩基という。
[酸の種類]
酸には,ハロゲン化水素(HF,HCl,HBr,HI)や硫化水素H2S,シアン化水素HCNなどを水に溶かした水素酸のような二元酸に対し,多元酸では,中心原子に酸化物イオンO2-の配位した陰イオンを成分とするオキソ酸(古くは酸素酸あるいはオキシ酸といった)が古くからよく知られている。たとえば,硝酸HNO3,過塩素酸HClO4,硫酸H2SO4,炭酸H2CO3,リン酸H3PO4などである。…
【水素酸】より
…たとえば塩酸HCl,ヨウ化水素酸HI,硫化水素酸H2S,シアン化水素酸HCN,クロロ白金(IV)酸H2PtCl6などがその例である。これに対して,硫酸H2SO4,硝酸HNO3,リン酸H3PO4,クロム酸H2CrO4などのような酸素を含む酸はオキソ酸(以前は酸素酸といった)という。またカルボキシル基,水酸基を有する有機酸,たとえば酢酸CH3COOH,酒石酸(CHOH)2(COOH)2などはカルボン酸と呼び水素酸とはいわない。…
※「オキソ酸」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
目次 飼養文化 北アメリカ 北方ユーラシア偶蹄目シカ科の哺乳類。北アメリカでは野生種はカリブーcaribouと呼ばれる。角が雄だけでなく雌にもふつうある。体長130~220cm,尾長7~20cm,...