化学辞典 第2版 「ヒ酸」の解説
ヒ酸(塩)
ヒサンエン
arsenic acid(arsenate)
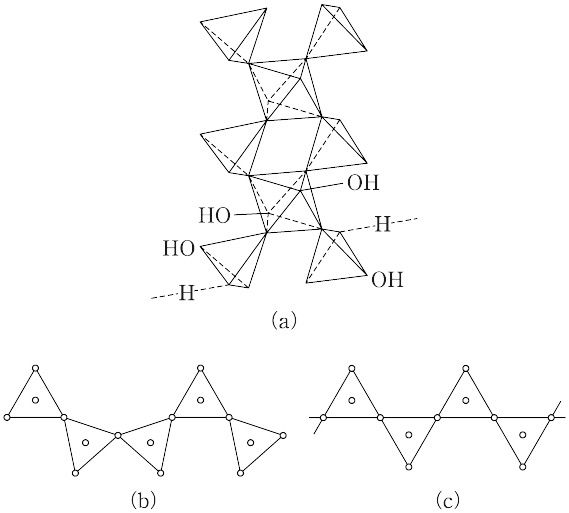
酸:H3AsO4(141.94).As2O3またはAsを濃硝酸で酸化すると生成する.液を濃縮すると,室温では0.5水和物ができる.無水物は得られない.-30 ℃ 以下では二水和物が得られる.正四面体型のAsO(OH)3とH2Oが,2:1に水素結合でつながっている.0.5水和物は,無色の単斜晶系結晶.融点35.5 ℃.潮解性があり,水に易溶,エタノールに可溶.有毒.水溶液は酸性を示す.K1 6.3×10-3,K2 1.3×10-7,K3 3.2×10-12.酸性水溶液中で酸化剤としてはたらく.たとえば,I- を I2 に酸化する.濃塩酸酸性中で,H2SによりAs2S5を生じる.ヒ酸塩,医薬品,染料などの製造に用いられる.0.5水和物を融点(35.5 ℃)より高温に加熱すると,図(a)に示した正八面体型のAsO6(As-O1.82 Å)と,正四面体型のAsO4(As-O1.69 Å)がO原子を共有して無限鎖状につながり,鎖間の水素結合があるH5As3O10になる.さらに高温では,約170 ℃ でAs2O5になる.[CAS 7778-39-4].
塩:正塩,酸性塩があり,それぞれ正四面体型の [AsO4]3-,[HAsO4]2-,[H2AsO4]- を含む.それぞれの相当するリン酸塩に似て結晶が同型で,混晶をつくるものも多い.リン酸によくみられるようなポリ酸塩も固体ではいくつかみられるが,より不安定で水溶液中では加水分解してAsO43- になる.アルカリ金属塩は,水に易溶,ほかの金属塩(アルカリ土類金属,Ag,周期表12~14族,遷移元素など)は水に難溶.
アルカリ金属塩:(1)Na3AsO4(297.89).水溶液中で計算量のNa2HAsO4とNaOHを反応させるか,As2O3をNaOH水溶液に溶かし,乾こ後NaNO3と強熱すると得られる.水和物もあり,水に易溶,エタノールに可溶.水溶液は強アルカリ性を示す.防虫剤,木材の防腐剤などに用いられる.[CAS 13464-38-5].
(2)Na2HAsO4(185.91).ヒ酸水溶液に計算量よりやや過剰のNa2CO3を加え,濃縮すると七水和物が得られる.七水和物は無色の単斜晶系結晶.正四面体型のAsO3(OH)を含む.水に易溶.水溶液はリトマスにアルカリ性を示す.加熱すると,50 ℃ で二水和物,100 ℃ で無水物が得られる.240 ℃ でNa4As2O7になる.染色,ほかのヒ酸塩の原料に用いられる.[CAS 7778-42-0].
(3)KH2AsO4(180.03).ヒ酸水溶液に計算量のKOHを加え,濃縮すると得られる.無色の正方晶系結晶.240 ℃ 以上ではK3[AsO3]3になる.繊維,なめし革,紙工業用,防虫剤などに用いられる.[CAS 7784-41-0].
ほかの金属塩:多くは水に難溶性で,ヒ酸か,そのアルカリ金属塩水溶液と各金属塩との複分解で得られる.ヒ酸カルシウム,ヒ酸鉛など,実用性のものがある.重金属の塩には着色したものが多い.たとえば,Ag3AsO4は,水溶性のヒ酸塩の水溶液に硝酸銀を加えると得られる赤褐色の沈殿で,ヒ酸塩の定性分析で確認反応用となる.前述のヒ酸塩鉱石も多くが着色している.
ポリ酸塩:一水素塩を熱すると二ヒ酸塩MⅠ4As2O7を,二水素塩を熱するとメタヒ酸塩MⅠAsO3を生じる場合が多く,この反応はリン酸塩に似ており,生成物も相当する各リン酸塩に似ていて同型の場合もある.ただし,リン酸の場合よりは不安定で,水を加えると分解して単量体に戻る.メタヒ酸塩はリン酸塩と同じく,環状のものと,無限鎖状のものとがある.たとえば,KH2AsO4の加熱で得られたK3[AsO3]3は,3個の四面体型のAsO4が頂点O原子共有でつながった環状の三量体であり,Ti4[AsO3]4は,環状の四量体である.鎖状オリゴマーの例としてのK5As3O10は,鎖状の三量体で,As-As-As骨格をもち,∠As-As-As約105°の折れ線形である.一方,NaH2AsO4を加熱すると得られるNaAsO3は,図(b)のように正四面体型のAsO4が,両隣りのAsO4と各1個のO原子を共有して無限鎖をつくっている.一方,LiAsO3も同方式の無限鎖型であるが,図(c)のように,鎖の形がやや異なる.[CAS 15120-17-9:NaAsO3]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報

