精選版 日本国語大辞典 「化学式」の意味・読み・例文・類語
かがく‐しきクヮガク‥【化学式】
- 〘 名詞 〙 元素記号を用いて、物質の組成、結合関係、性質などを表わした式。分子式、構造式、示性式、実験式などがある。〔いろは引現代語大辞典(1931)〕
日本大百科全書(ニッポニカ) 「化学式」の意味・わかりやすい解説
化学式
かがくしき
chemical formula
元素(原子)記号、数字などを組み合わせて化学物質を表現する記号。組成式、実験式、分子式、示性式、構造式などがある。
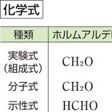
組成式
物質を構成する原子の種類と、それぞれの原子の個数の比を示す式。単体であれば、すべて元素記号と同じになる。化学式としてはもっとも簡単なもので、物質を区別するのには適さない。たとえば、アセチレンもベンゼンも組成式はCHになる。
[岩本振武・中原勝儼]
実験式
化合物の組成は元素分析によって実験的に定められる。実験結果から得られた組成式が実験式であるが、通常の場合、原子の個数の比は、実験誤差のために、厳密な整数比にはならない。しかし、化合物が明確な分子をもつときには、整数比にきわめて近い値が得られるので、実験式と組成式は同じものであるとされることが多い。
化合物によっては、構成原子の比が簡単な整数比にならないものがあり、それらは不定比化合物、非化学量論化合物、ベルトライド化合物などとよばれる。たとえば、チタンの酸化物にはTiO0.60~1.35のような、組成が連続的に変化するものがあり、この種の化合物では実験式が一定にならず、TiOx(x=0.60~1.35)のように組成式が書かれることもある。
[岩本振武・中原勝儼]
分子式
組成式がわかっている物質の分子量を測定すると分子式が得られる。分子式は分子を構成する原子の種類と個数を示す。単体の水素、酸素、窒素は分子量から二原子分子であることがわかり、それらの分子式はH2、O2、N2となる。リンにはP4、硫黄(いおう)にはS8の分子式をもつ同素体がある。同一の組成式をもつアセチレンとベンゼンでは、分子量がそれぞれ26.04、78.11となり、CHにおける原子量の和13.02の2倍および6倍となるので、分子式はC2H2およびC6H6となる。
共有結合性巨大分子、イオン結合性結晶、高分子化合物のような、明確に独立した少数原子よりなる分子をもたない物質では、分子式を正確に書くことができないので、組成式、あるいは次に述べる示性式で表すことが多い。
[岩本振武・中原勝儼]
示性式
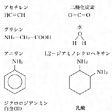
組成式あるいは分子式を、基、酸イオン、配位子などの原子団に分けて書き改めたものが示性式である。たとえば、ミョウバンの組成式はAlKH24O20S2となるが、成分イオンなどを明示したKAl(SO4)2・12H2Oの示性式で表せば、硫酸アルミニウムカリウム12水和物であることがわかる。エタノール(エチルアルコール)もジメチルエーテルも、分子式はC2H6Oと同じになるが、の(2)のように示性式で示せば、それぞれエチル基C2H5-をもつアルコール、メチル基-CH32個をもつエーテルであることがわかる。ポリ塩化ビニルは分子式を定めにくい高分子であるが、(CH2CHCl)nのように、構成単位を示す示性式で表すことが多い。化学的には示性式を用いるのが便利であり、分子式にかわって広く用いられ、有機化合物や錯体では、分子式といえばむしろ示性式をさす場合が多い。
[岩本振武・中原勝儼]
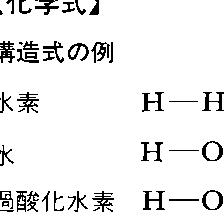
構造式
示性式をさらに詳しくして、各原子が結合している幾何学的関係を示すのが構造式である。共有結合性の化合物に広く用いられ、とくに有機化合物では同じ分子式でも性質の違うもの、すなわち異性体が多いものに欠かすことのできない重要な式となっている。共有結合している原子の間は価標とよばれる線で結び、1本で単結合、2本で二重結合、3本で三重結合を表す。エタノールとジメチルエーテルの例ではの(3)のようになるが、分子内の各種原子団が他と混同されるおそれのないときは、官能基をひとまとめにした示性式の要素を取り込んだ形の構造式も広く用いられる(の(4))。
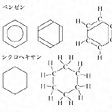
ベンゼン環のような芳香族の環、シクロヘキサン環のように脂肪族の環も、各原子を示さず、炭素原子に結合した水素原子も省略した、六角形のような多角形で表すことが普通である()。ベンゼン環では、炭素原子間に単結合と二重結合が交互に連なっているわけではなく、各結合は等価であり、環は正六角形になっているので、六角形の中に丸を書いた式もよく使われる。
シクロヘキサン環はすべて一本価標の六角形で示される。このような簡略化された構造式を含めた例をに示すが、これらのなかで、たとえば二酸化炭素分子は直線状、水分子はV字形の構造をもつので、このように書くことも多い。また、ジアンミンジクロリド白金(Ⅱ)は平面正方形型錯体で、白金および各配位原子は同一平面上にあるが、乳酸では中央の炭素原子が四面体の中心にあって、それに結合している各原子が四面体の頂点を占める立体構造をもっている。多くの有機化合物では平面構造式で構造を示すことができるので、便利なため広く用いられているが、光学異性体その他さらに複雑なものはより正確に構造を示すことができる立体構造式、投影式などで示す。無機化合物では結合様式が有機化合物よりもはるかに複雑であり、立体構造も多様なので、簡単な共有性分子には使われるが、多くの場合、立体構造式のほうが用いられる。
[岩本振武・中原勝儼]
改訂新版 世界大百科事典 「化学式」の意味・わかりやすい解説
化学式 (かがくしき)
chemical formula
元素記号を組み合わせて物質を表した式。これにより物質をつくっている元素の種類のみならず,その組成も知ることができる。物質が分子からできている場合にはとくに分子式molecular formulaといい,多原子分子やイオンでは,元素記号の右下に1個の分子あるいはイオンを構成する原子の数を表す数字を小さく記す。ただし1という添字はつけない。たとえば,水素H2,酸素O2,水H2O,二酸化炭素CO2,アンモニウムイオンNH4⁺,エチルアルコールC2H6O,ベンゼンC6H6などである。硫黄やリンのように分子量が温度などによって変わる場合には,S8,P4ではなくて,最も簡単な式S,Pを用いる。また食塩のようにイオン格子から成るものや,ダイヤモンドのように結晶全体にわたり結合しているような,いわゆる個々の分子が存在しない物質では,その最も簡単な式を用い,食塩はNaCl,ダイヤモンドはCで表す。異なった元素から成る化合物では,電気的に陽性な元素の部分(陽イオン)を先に書く。たとえばCuSO4,(NH4)2CO3などである。電気的陽性または陰性の部分が2種以上ある場合には,それぞれの部分の中では元素記号のアルファベット順に並べ,多原子イオンでは中心元素の記号に注目して並べる。たとえばKMgPO4,Ba2Cl2F2などである。非金属元素から成る化合物では,つぎの系列で前にある元素を先に書く。B,Si,C,P,N,H,S,I,Br,Cl,O,F。たとえば,NH3,H2S,HCl,CO2,SO3などである。3元素以上が含まれている鎖状の化合物では,一般に,実際に結合している順序,たとえばNCS⁻のように表す。
アセチレンとベンゼンの組成を元素分析で調べると,いずれも炭素原子1に対し水素原子1の割合であるから,これらの分子の実験式はいずれもCHである。しかしそれぞれの分子量を実験的に求めるとアセチレンは26.0,ベンゼンは78.1で,CHで与えられる式量の2倍および6倍であるから,分子式はそれぞれC2H2,C6H6である。このように分子式はその分子量も表している。
分子の中の原子の結合のありさまを模式的に表したものを構造式constitutional formula(structural formula)という。構造式では結合している原子と原子の間を価標とよばれる線でつなぐ(図参照)。エチルアルコールとメチルエーテルとは分子式はともにC2H6Oで同じであるが,構造式で示すと異なる物質であることが明らかにされる。
化合物を構造式で表示するのが厳密ではあるが,煩雑になる場合には,その化合物の化学的性質を決めるうえで重要な役割を果たしている基の種類や数に注目して,それを明示した示性式rational formulaを用いる。たとえば,エチルアルコールはエチル基C2H5-とアルコール性水酸基-OHとが結合したものとしてC2H5OHで示す。立体異性体の原子や基の空間的配列順序をも表すのには立体構造式を用いる。
執筆者:佐野 瑞香
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「化学式」の意味・わかりやすい解説
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「化学式」の解説
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
栄養・生化学辞典 「化学式」の解説
化学式
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...