精選版 日本国語大辞典 「酸化窒素」の意味・読み・例文・類語
さんか‐ちっそサンクヮ‥【酸化窒素】
- 〘 名詞 〙 窒素の酸化物。
- ① 酸化二窒素。化学式 N2O 常温常圧で無色透明の気体。液体・固体とも無色透明。吸入すると顔の筋肉をけいれんさせ笑うような表情となるので笑気ともいう。吸入麻酔薬に用いられる。亜酸化窒素。
- ② 一酸化窒素。化学式 NO 無色気体。反応性にすぐれ、多くの金属とニトロシル化合物をつくる。
- ③ 三酸化二窒素。化学式 N2O3 常温で赤褐色の気体。液体は青色、固体は青色の正方晶系結晶。三二酸化窒素。無水亜硝酸。
- ④ 二酸化窒素。化学式 NO2 常温で赤褐色の気体。液体は黄色、固体は無色。反応性にすぐれる。過酸化窒素。
- ⑤ 五酸化二窒素。化学式 N2O5 無色透明のプリズム状固体。吸湿性で水に溶けると硝酸になる。五二酸化窒素。無水硝酸。
- ⑥ 三酸化窒素。化学式 NO3 窒素または窒素の酸化物とオゾンまたは酸素との反応によって生ずる気体。
- ⑦ 六酸化二窒素。化学式 N2O6 緑色の固体。酸化窒素と液体空気または液体酸素との反応によって生ずる。
改訂新版 世界大百科事典 「酸化窒素」の意味・わかりやすい解説
酸化窒素 (さんかちっそ)
nitrogen oxide
窒素の酸化物の総称で,次の6種が知られている。単に酸化窒素というときは一酸化窒素NOをさす場合が多い。
一酸化二窒素dinitrogen monooxide
化学式N2O。酸化二窒素,亜酸化窒素(俗称)とも呼ばれる。硝酸アンモニウムを熱分解するとたやすく生成する。
NH4NO3─→N2O+2H2O
常温・常圧で無色の気体。軽い芳香がある。融点-90.8℃,沸点-88.5℃。水に対する溶解度130.52ml/100ml(0℃)。室温では反応性が小さく安定である。アルカリ金属,酸素,オゾン,水素,ハロゲンとも反応しない。温度を上げると反応性は高くなり,木片,リン,硫黄などは空気中よりもよく燃える。
執筆者:漆山 秋雄 吸入すると顔面の筋肉が弛緩して笑ったように見えるので笑気とも呼ばれる。約70%の亜酸化窒素を酸素と混合して吸入させると無痛状態となるため,歯科の小手術,その他の浅麻酔の目的で用いられたことがある。毒性,刺激性が少なく,安全な吸入麻酔薬であるが作用が弱いので,他の麻酔薬と併用される。
執筆者:渡辺 和夫
一酸化窒素nitrogen monooxide
化学式NO。硝酸を金属で還元するか,亜硝酸塩とヨウ化アルカリと酸の反応で生成する。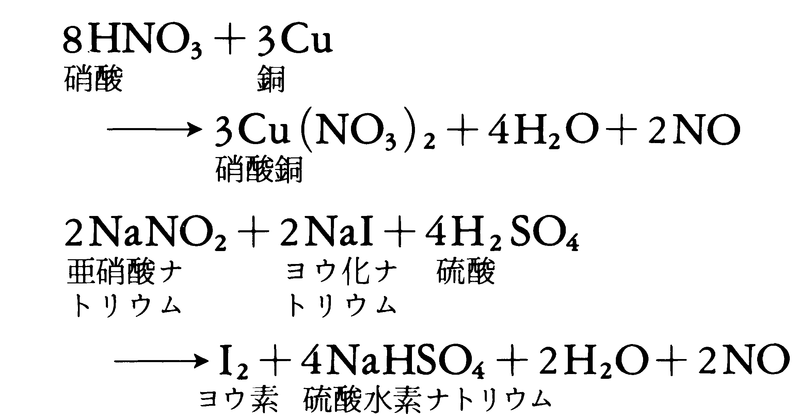
窒素と酸素とを高温で直接反応させても得られるが,工業的には,アンモニアを白金-ロジウム合金触媒などを用い,酸素気流中で800~900℃に熱して製造する。これはアンモニアから硝酸をつくる際の重要な反応である。無色の気体。融点は-163.6℃,沸点-151.8℃,水に対する溶解度7.35ml/100ml(0℃)。酸素にふれると速やかに酸化されて褐色の二酸化窒素となる。
2NO+O2─→NO2
ニトロシルイオンNO⁺がたやすく生成し,NO⁺HSO4⁻,NO⁺ClO4⁻,NO⁺BF4⁻,NO⁺MoF6⁻,NO⁺SbCl6⁻などの化合物がある。ハロゲンと反応してハロゲン化ニトロシルNOX(X=ハロゲン)をつくる。多くの遷移金属ニトロシル錯体が知られている。たとえば[Fe(CN)5(NO)]2⁻,[PtCl5(NO)]2⁻など。このうち硫酸鉄(Ⅱ)と生ずる不安定な褐色のニトロシル錯体は,褐輪反応として硝酸塩,亜硝酸塩の検出に利用される。
三酸化二窒素dinitrogen trioxide
化学式N2O3。無水亜硝酸と俗称する。硝酸を三酸化二ヒ素またはデンプンで還元するか,亜硝酸ナトリウムに硝酸を作用させると得られる。赤褐色の気体。液体と固体は青色。融点-102℃。液体では一部が二酸化窒素NO2と一酸化窒素NOに解離し,温度の上昇とともに解離度が増す。気体では未解離部分が25℃で10.5%,100℃で1.2%で,ほとんど解離しているといえる。水溶液は青色で,亜硝酸を含むが,すぐ分解して硝酸と一酸化窒素になる。アルカリに溶かすと亜硝酸塩を生ずる。
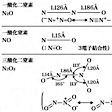
二酸化窒素nitrogen dioxide,四酸化二窒素dinitrogen tetroxide
前者の化学式はNO2,後者はN2O4。分子構造は表に示すように,NO2は折れ線構造であり,N2O4の安定な構造はNO2の二量体である。これらは平衡混合物として存在する。
2NO2⇄N2O4+12.8kcal
低温では無色固体で,すべてがN2O4である(凝固点-9.3℃)。温度が上昇すると黄色が増し,液体では深赤褐色となる(沸点21.3℃)。27℃でNO2:N2O4は20:80(%),100℃で90:10,140℃以上ではほとんど純粋なNO2となる。一酸化窒素を空気で酸化するか,金属硝酸塩を熱すると得られ,また五酸化二窒素N2O5を熱分解しても生成する。二硫化炭素,クロロホルムに可溶。水と反応して硝酸と亜硝酸HNO2を生じ,亜硝酸は分解して硝酸と一酸化窒素となる。
2NO2+H2O─→HNO3+HNO2
3HNO2─→HNO3+2NO+H2O
NO2は150℃で熱分解しはじめ,600℃で完全に分解する。
2NO2─→2NO+O2
強酸化剤で,カリウム,リン,炭素,硫黄などはその中で燃える。アンモニアとは激しく反応して硝酸アンモニウムを生成する。そのほか,他の基との結合,炭化水素の脱水素反応が知られており,反応性が高い。液体のN2O4は非水溶媒として用いることもできる。NO2は毒性が強く,慢性中毒では気道,肺などに症状が出る。大気汚染成分の窒素酸化物NOxはNOとNO2をまとめたもので,大気汚染防止法に環境基準が設定されている。NO2はさらに光化学反応によってオゾンO3を発生させ,オキシダント汚染の原因ともなる。
NO2+hν(光のエネルギー)─→NO+O
O+O2─→O3
五酸化二窒素dinitrogen pentoxide
化学式N2O5。硝酸を五酸化二リンP2O5で脱水して得られる。
2HNO3+P2O5─→2HPO3+N2O5
無色の結晶。融点30℃,常温で徐々に分解して二酸化窒素と酸素になる。吸湿性で水に溶けると硝酸となる。各種有機溶媒に溶ける。
ほかに三酸化窒素NO3,六酸化二窒素N2O6も存在するというが,ともに不安定で,詳しいことはわかっていない。
執筆者:漆山 秋雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「酸化窒素」の意味・わかりやすい解説
酸化窒素
さんかちっそ
nitrogen oxide
窒素の酸化物の総称で、酸化数ⅠからⅤまでの化合物が知られているが、一般には一酸化窒素NOをさすことが多い。また環境用語で窒素酸化物というときは一酸化窒素と二酸化窒素の混合物であるいわゆるノックスNOxをさすことが多い。
一酸化窒素nitrogen monoxideは、亜硝酸塩とヨウ化水素酸の反応で得られる。工業的には、触媒の存在下でアンモニアの酸素酸化で得られる。また空気中で高温燃焼があると生成するので、工場の煙突からの排ガス、あるいは自動車その他の内燃機関の燃焼排ガス中に含まれる。その他大気中の放電によっても生成される。無色の常磁性気体。空気中で酸化されて赤褐色の二酸化窒素NO2になる。水には溶けにくい。窒素と酸素から高温で直接生成するので、二酸化窒素とともに大気汚染源となる。多くの物質と反応しやすく、酸化されやすい。金属塩の溶液に吸収されやすく、たとえば、硫酸鉄(Ⅱ)とは不安定な褐色のニトロシル化合物をつくるので、検出に用いられる。硝酸製造原料である。多くの遷移金属と金属ニトロシルをつくる。空気中ではNO2とN2O4の混合物となり、毒性が強い。
三酸化二窒素は無水亜硝酸と俗称することもある。酸化ヒ素(Ⅲ)に硝酸を作用させて得られる褐色の気体でON-NO2分子からなる。一酸化窒素と二酸化窒素を低温で反応させても得られる。液体と固体は青色。不安定で水に溶けて亜硝酸を生じるが、さらに硝酸と一酸化窒素になる。
三酸化窒素NO3は、窒素の酸化物とオゾンの反応によって生じる不安定な濃青色の気体。また、六酸化二窒素N2O6は、二酸化窒素と液体酸素との反応によって生成するきわめて不安定な緑色固体である。
ほかに、一酸化二窒素(亜酸化窒素)N2O、二酸化窒素、四酸化二窒素N2O4、五酸化二窒素N2O5がある()。
[守永健一・中原勝儼]
酸化窒素(データノート1)
さんかちっそでーたのーと
一酸化窒素
NO
式量 30.01
融点 -163.6℃
沸点 -151.8℃
密度 1.3402g/dm3(20℃,1気圧)
溶解度 7.35mL/100mL(水0℃)
臨界温度 -92.9℃
臨界圧 64.6atm
酸化窒素(データノート2)
さんかちっそでーたのーと
三酸化二窒素
N2O3
式量 76.0
融点 -102℃
沸点 3.5℃(分解)
比重 1.447(測定温度2℃)
化学辞典 第2版 「酸化窒素」の解説
酸化窒素
サンカチッソ
nitrogen oxide
窒素の酸化物として,Nの酸化数1から5までの,次の6種類が一般に知られている.一酸化二窒素N2O(44.01),一酸化窒素NO(30.01),三酸化二窒素N2O3(76.01),二酸化窒素NO2(46.01),四酸化二窒素N2O4(92.01),五酸化二窒素N2O5(108.01).これ以外に不安定なものとして三酸化窒素NO3(62.00)とその二量体にあたる六酸化二窒素N2O6(124.01)がある.大気汚染成分の一つに窒素酸化物NOxがあるが,このものは高温での燃料の空気酸化および空気中の窒素と酸素の化合により生じるNOとNO2の両者をまとめていう.[CAS 0-01-1]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「酸化窒素」の意味・わかりやすい解説
酸化窒素【さんかちっそ】
→関連項目化石燃料|クリーンエネルギー
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「酸化窒素」の意味・わかりやすい解説
酸化窒素
さんかちっそ
nitrogen oxide
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「酸化窒素」の解説
酸化窒素
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...