内科学 第10版 「黄疸の病態生理」の解説
黄疸の病態生理(肝・胆道の疾患)
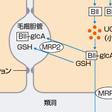
ビリルビンは約80%が老廃赤血球ヘモグロビンのヘムに由来し,細網内皮系,特に脾臓で生成される.ヘムのポルフィリン環のαメチン部がヘムオキシゲナーゼで開環されて生じるビリベルジンがさらに還元されてビリルビンが生成される.一部は,赤血球が完成する前に骨髄で壊されたものや肝内のヘム含有酵素に由来する.成人でのビリルビン生成量は1日300 mg前後である.健常人の血清ビリルビン濃度は0.2~1.0 mg/dL(3.4~17.1 μmol/L)で,ほぼすべてが非抱合ビリルビンで占められる.非抱合ビリルビンは水に不溶のため,血中ではアルブミンと強く結合して運ばれる.肝に至ったビリルビンは,能動輸送により肝内に取り込まれる.
肝内に取り込まれたビリルビンはリガンディンなどのサイトゾール蛋白と結合して小胞体に運ばれると考えられている.小胞体の内腔に至ると,ビリルビンUDP-グルクロン酸転位酵素 (UGT1A1)により抱合され水溶性になる.UGT活性が十分であれば,約80%はグルクロン酸が2分子抱合したジグルクロニドになる.毛細胆管膜に至った抱合ビリルビンは,multidrug resistance protein 2(MRP2, ABCC2)により毛細胆管内に排泄されるか,類洞側膜のMRP3(ABCC3)により血中に逆流する.血中に逆行した抱合ビリルビンは下流すなわち,より中心静脈よりの肝細胞索にある肝細胞のOATP1B1およびOATP1B3により再び肝細胞に取り込まれる. 毛細胆管に排出されたビリルビンは胆汁成分の1つとして,胆管を経て十二指腸に排泄される.抱合ビリルビンは,腸内細菌のβ-グルクロニダーゼによりグルクロン酸が脱抱合された後,さらに還元されウロビリノーゲンになる.便のなかにはウロビリノーゲンとその酸化物である橙色のウロビリン体とが含まれる.ウロビリノーゲンの約20%は腸管で吸収されて肝に至り,一部は尿中に排泄される.なお,健常人では小腸でのビリルビンの再吸収は起こらないが,空腹により腸管運動が低下した場合や,胆汁酸吸収不全により腸管内に胆汁酸が増加して非抱合ビリルビンが可溶化された場合には,非抱合ビリルビンの腸管吸収が増加し,腸肝循環が起こる.
(2)黄疸の病態生理
図9-1-7に示したビリルビン代謝のいずれかの過程に異常があると黄疸が生じる(原因疾患は【⇨表2-3-1】).
溶血性黄疸やシャント高ビリルビン血症では,ビリルビンの産生過剰のためグルクロン酸抱合が間に合わなくなり,非抱合ビリルビンが増加する.Gilbert症候群およびCrigler-Najjar症候群Ⅱ型では,UGT1A1遺伝子の異常による同酵素活性の低下のため非抱合ビリルビンが増加する.肝細胞性黄疸では,ビリルビンの肝取り込みから毛細胆管膜への排泄の各過程の障害により抱合ビリルビンが増加すると考えられている.Dubin-Johnson症候群では,MRP2の遺伝子異常によって抱合ビリルビンの胆汁中への排泄が障害され,血中に逆流することによって抱合ビリルビンが増加する.Rotor症候群では,OATP1B1とOATP1B3の両者の機能障害により,血中に逆流した抱合ビリルビンの肝細胞への再取り込みが障害されるために生じる.
肝細胞から十二指腸までの胆汁排泄経路の異常は胆汁うっ滞とよばれ,毛細胆管膜レベルおよび肝内胆管の異常による肝内胆汁うっ滞と肝外胆管の機械的閉塞に基づく閉塞性黄疸とに大別される.
(3)胆汁酸代謝と胆汁分泌機構(図9-1-7)
腸管で吸収された胆汁酸は門脈を介して肝に戻り,Na+/taurocholate cotransporting polypeptide (NTCP)によりNa+依存性に,OATP1B1によりNa+非依存性に肝細胞内に取り込まれる.さらに細胞質内を移動し,肝内でコレステロールから生合成されたアミノ酸抱合胆汁酸とともに,bile salt export pump(BSEP, ABCB11)により毛細胆管内に排泄される.胆管を経て腸管に排泄された胆汁酸の大部分は,腸管吸収によりそのほとんどが門脈を経て肝に戻り,再び胆管を経て腸管に排泄されるという効率のよい腸肝循環を営んでいる.腸管吸収には,回腸末端の小腸細胞の内腔側膜のNa+依存性胆汁酸トランスポーターであるapical sodium-dependent bile acid transporter(ASBT)と血管側膜に存在するorganic solute transporter α/β(OSTα/β)が重要な役割を果たしている.肝細胞から毛細胆管への排泄が障害されると,類洞側膜にMRP4の発現が誘導され,肝細胞内に増加したアミノ酸抱合胆汁酸を血中に逆流させる.胆汁酸でも硫酸やグルクロン酸抱合体は,MRP2により胆汁中に排泄される.
胆汁は,肝細胞の働きにより生成される毛細胆管胆汁と太い胆管より分泌される胆管胆汁に大別される.前者はさらに,肝細胞から排泄される胆汁酸量に比例して増加する胆汁酸依存性胆汁と,胆汁酸排泄と無関係の胆汁酸非依存性胆汁とに分けられる.ヒトの1日の胆汁流量は約750 mLであり,その内訳は胆汁酸依存性胆汁,非依存性胆汁および胆管胆汁が各々250 mLとされている.胆汁酸の毛細胆管内への排泄に伴って生成される胆汁酸依存性胆汁は,胆汁酸排泄量に比例して増加する.胆汁酸非依存性胆汁の起動力の一部は,肝で合成され胆汁中にMRP2によって排泄されるグルタチオンが担っている.胆管胆汁はHCO3−に富んだ胆汁であり,セクレチンによって分泌が増加する.これはcystic fibrosis transmembrane conductance regulator(CFTR)とよばれるCl−チャネルを介したものであるが,ヒトでの詳細はまだ不明である.
(4)肝内胆汁うっ滞
肝細胞や肝内胆管の異常により胆汁流量が減少した病態である.臨床的には,ビリルビン,胆汁酸,コレステロールやリン脂質などの胆汁中排泄物が血中に逆流し,胆道系酵素の上昇がみられる.その機序は不明なことが多いが,先天性肝内胆汁うっ滞の多くでは毛細胆管膜トランスポーターの遺伝子異常が明らかになっている.
黄疸が長期にわたると皮膚瘙痒感もみられる.慢性の肝内胆汁うっ滞では脂質異常症による黄色腫を認めることもある.その他,肝脾腫,胆汁中への胆汁酸排泄の低下による脂肪便,ビリルビン排泄の低下による便の色の変化も起こりうる.血液検査上は,ALPやγ-GTPなどの胆道系酵素の増加,直接型優位のビリルビンの増加,コレステロールおよび胆汁酸の増加を認める.ALPアイソザイムではALP2が増加する.急性肝内胆汁うっ滞では画像診断上,肝は正常のことが多く,肝生検で毛細胆管の胆栓形成や肝細胞内のビリルビン沈着がみられるほか,黄疸の遷延に伴い,Kupffer細胞はビリルビンを取り込み腫大する.長期の肝内胆汁うっ滞では,細胆管周囲炎,細胆管増生や胆管消失がみられることもある.症状が遷延した場合はウルソデオキシコール酸,副腎皮質ステロイド,フェノバルビタールなどを投与する.瘙痒感に対しては,陰イオン交換樹脂であるコレスチミドを投与する.経過が長期にわたる場合は,脂溶性ビタミンの補給も必要である.肝内胆汁うっ滞は表2-3-1のように経過により分類する場合もあるが,ここでは原因別に分類することにする.
1)ウイルス性肝内胆汁うっ滞:
A型肝炎およびB型急性肝炎の回復期に,トランスアミナーゼ値が正常化したのにもかかわらず,ビリルビンと胆道系酵素の増加が持続し,肝内胆汁うっ滞となる症例がある.
2)薬物性肝内胆汁うっ滞
【⇨9-9】
3)自己免疫性肝内胆汁うっ滞:
原発性胆汁性肝硬変【⇨9-6】と原発性硬化性胆管炎【⇨9-7】とがある.
4)重症感染症による肝内胆汁うっ滞:
重症感染症に伴って肝内胆汁うっ滞が起こることがある.Gram陰性桿菌が産生するエンドトキシンが,サイトカインを介して胆汁うっ滞を起こす.サイトカインによりMRP2が減少して抱合ビリルビンの排泄障害が生じた結果,高ビリルビン血症のみが生じる場合もある.
5)術後肝内胆汁うっ滞:
手術後に肝内胆汁うっ滞が起こることがあるが,種々の因子が関与しており病態は複雑である.重症感染症の場合と同様,単なる高ビリルビン血症と区別する必要がある.
6)中心静脈栄養による肝内胆汁うっ滞:
長期の中心静脈栄養によって生じることがあり,未熟児で頻度が高いが成人でもみられる.発生機序は不明である.
7)妊娠性反復性肝内胆汁うっ滞:
妊娠末期に生じる肝内胆汁うっ滞で瘙痒感を伴い,多くは出産により軽快する.一部の症例は,小児の進行性家族性肝内胆汁うっ滞(progressive familial intrahepatic cholestasis:PFIC)3型の原因遺伝子と同じMDR3(ABCB4)の遺伝子異常による.
8)良性反復性肝内胆汁うっ滞(benign recurrent intrahepatic cholestasis:BRIC):
自然経過で黄疸の消退を繰り返す疾患である.PFIC1型(Beyler病)と同じく,FIC1の遺伝子異常によって起こるが,胆汁うっ滞が生じる機序は不明である.BRICのなかにPFIC2型と同じくBSEPの遺伝子異常による症例も発見され,BRIC2型とよばれている.[滝川 一]
出典 内科学 第10版内科学 第10版について 情報