内科学 第10版 「Alzheimer病」の解説
Alzheimer病(大脳変性疾患)
定義・概念
1907年,ドイツのAlois Alzheimerは進行性の認知症で死亡した50歳代の女性を報告した.この患者の脳には老人斑と神経原線維変化という特徴的な構造物がみられた.当初,この病理学的特徴を有する病態は初老期(65歳未満)発症のまれな認知症と考えられたが,その後,老年期に発症する認知症にも,しばしば同様の病理所見がみられることが判明した.かつて,老年期発症例は「Alzheimer型老年痴呆」として区別されたが,発症年齢では本質的には区別されないことから,現在では,発症年齢にかかわらず,Alzheimer型認知症,あるいは単にAlzheimer病(AD)と称される.すなわち,進行性認知症を呈し,神経細胞脱落とともに老人斑や神経原線維変化を認める病態がADと定義される.
病理・病因・病態生理
1)病理:
脳萎縮は側頭葉,頭頂葉,前頭葉にみられるが,特に側頭内側部の海馬領域に強調される(図15-6-1A,B).組織学的には,嗜銀性の構造物である老人斑,神経原線維変化とともに,神経細胞やシナプスの脱落を認める.老人斑や神経原線維変化は健常高齢者でも少量みられるが,ADでは大量かつ広汎に分布する.典型的老人斑は電顕的に線維構造を示すアミロイドのコアの周囲に変性神経突起が集簇している.神経原線維変化は電顕的にはペアになった螺旋状フィラメント(paired helical filament:PHF)構造を示す.コリン作動性神経細胞(Meynert基底核から大脳皮質に投射)が特に侵されやすい.
2)病因・発症機序:
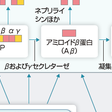
a)生化学的研究:老人斑の主成分は40あるいは42個のアミノ酸からなるアミロイドβ蛋白(Aβ:Aβ40/Aβ42)である(図15-6-1C).Aβは第21染色体上に存在する遺伝子によってコードされているAβ前駆体蛋白(APP)に由来する.膜貫通型蛋白であるAPPの大部分は,APPのAβ構成部分の中央でαセクレターゼによって切断されてAβ産生に至らないが,α切断を受けずに,βセクレターゼおよびγセクレターゼによって次々と切断された場合にはAβが産生される(図15-6-2).Aβは凝集し最終的にアミロイド線維を形成する.Aβ凝集体は神経毒性を有し,特にオリゴマーとよばれる小さい凝集体は毒性が強い.また,脳内にはネプリライシンなどのAβ分解酵素を含む分解・除去機構も存在する.一方,神経原線維変化のPHFの主成分は微小管関連蛋白タウである(図15-6-1D).AD脳では過剰にリン酸化され不溶化したタウ蛋白(3および4リピートタウとよばれるアイソフォーム)が凝集・蓄積し,神経細胞体と突起にPHF構造が出現する(図15-6-2). b)分子遺伝学的研究:常染色体優性遺伝を示す家族性ADが一部にみられ,APP,プレセニリン1,プレセニリン2遺伝子の変異が報告された.APP遺伝子の変異によりAPPのプロセッシングが変化しADが発症することは,APPからAβ蓄積に至る経路が発症機構において中心的な役割を果たしていることを示している(アミロイドカスケード仮説).プレセニリンは膜貫通型蛋白で,細胞内シグナル伝達に重要な役割を果たす細胞表面受容体notch切断にかかわっている.APPのプロセッシングにおいて,プレセニリンはγセクレターゼの活性部位であり,APPを細胞膜内でγ切断する(図15-6-2).プレセニリン変異はγセクレターゼ活性を変化させAβ42産生を増加させる.一方,孤発性ADについては,アポリポ蛋白E遺伝子が疾患感受性遺伝子である.アポリポ蛋白EにはE2,E3,E4の3つのアイソフォーム(それぞれに対応するε2,ε3,ε4アリル)がある.E4は孤発性ADの危険因子であり,E4の数に比例してADのリスクは高まり,発症年齢も低くなる. c)疫学的研究:頭部外傷や生活習慣病(糖尿病,高血圧,脂質異常症)が高いリスク,低カロリー・低脂肪・魚・野菜,抗酸化作用を有する栄養因子を豊富に含む食事および運動が低いリスク,抗炎症薬,エストロゲン,スタチン類などの薬剤投与が低いリスクと関連することが報告されている.これらの因子の作用機序の解明研究が進んでいる.
これらの研究による知見を総合した発症機序(仮説)を図15-6-2に示す.遺伝子変異が確認される一部の家族例を除き病因は不明であるが,加齢を背景に遺伝的要因や環境要因が多因子性に作用し発症するものと考えられる.重要な点は,発症のはるか以前,おそらく十数年以上前から脳ではアミロイド形成が始まっていることである.
疫学
わが国の65歳以上の高齢者における認知症有病率は約10%で,その過半数はADとされる.有病率は加齢と共に増加し,女性の方が高い.多くは孤発性であるが,一部に遺伝性の家族性ADがある.
臨床症候
緩徐に発症し,軽度認知障害(mild cognitive impairment:MCI)(正常でも認知症でもない中間状態)の段階を経て,認知症が徐々に進行していく.典型的には以下のような経過を示す.
1)MCI段階:
近時記憶障害(最近の出来事を忘れてしまう)のみの段階である.日常生活にはほぼ支障がない.
2)初期(軽度認知症):
近時記憶障害が目立つようになり(数分前に話したことやエピソードを思いだせない),さらに時間に関する見当識の障害(日付を思い出せない),実行機能障害(段取りをつけて物事を実施できない)が出現する.自発性減退,うつ気分がみられ,物盗られ妄想が目立つ場合もある.
3)中期(中等度認知症):
認知機能全体の低下が著しくなる.時間ばかりでなく,場所に関する見当識の障害が現れる.さまざまな高次脳機能の障害(大脳巣症状)がみられ,失語(語健忘,錯語,反響言語,語間代など),失行(構成失行,観念運動失行,観念失行,着衣失行など),失認(視空間失認など),計算力低下などが明らかになる.妄想,徘徊,夕暮れ症候群(夕方になると落ち着かなくなり,自宅にいても自分の家に帰りたいという),食行動の異常[何でも食べようとする(口運び傾向oral tendency)]など,認知症の行動・心理症状(behavioral and psychological symptoms of dementia:BPSD)が目立つようになる.食事,排便,着衣など,身の回りのことに介護が必要になる.
4)後期(高度認知症):
重度の認知障害を示す.人物に関する見当識障害も出現し,近親者も忘れてしまう.思考も断片化し,何もできない状態になり,全面的な介護が必要で,最終的には寝たきりとなる.
初老期発症例では初期から失語,失認などの大脳巣症状がしばしばみられるのに対し,高齢発症例は記憶障害を中心に進行し巣症状が目立たない例が多い傾向がある.
検査成績
CT,MRIで側頭葉内側部を中心に萎縮が進行し大脳のびまん性萎縮に至る(図15-6-3).SPECTおよびPETで,早期には後部帯状回周辺,進行すると頭頂側頭葉の血流および糖代謝の低下を認める(図15-6-4).脳脊髄液のAβ42の減少,タウ(特にリン酸化タウ)の上昇がみられる.アミロイドに結合するトレーサーを用いたPETでアミロイド蓄積を示す集積を認める(図15-6-5).家族性ADではAPPあるいはプレセニリン遺伝子に変異がみられる場合がある.
診断・鑑別診断
従来のAD診断基準は,緩徐進行性の認知症(記憶障害を含む複数の認知機能の障害)のために日常生活,社会生活に支障をきたしていること,ほかの疾患が除外可能ということが基本的な骨子である.しかし,こうした診断基準では他疾患がADと誤診されやすいことが問題となり,また,MCI段階での早期診断が求められるようになった.そのため,診断カテゴリーに“ADによる認知症”ばかりでなく“ADによるMCI”を含み,ADの診断確実度を画像(MRI,糖代謝・アミロイドPET)や脳脊髄液マーカーで評価する新しい診断基準が近年呈示された.
譫妄,抑うつなどの認知症以外の病態,認知症をきたす他の疾患[血管性認知症,非Alzheimer型変性型認知症(Lewy小体型認知症,前頭側頭型認知症など),認知症をきたす内科的・脳外科的疾患]を鑑別する.内科疾患(甲状腺機能低下症,ビタミンB1,B12欠乏症,神経梅毒など)や脳外科疾患(慢性硬膜下血腫,正常圧水頭症など)に伴う治療可能な認知症を見逃してはならない.
経過・予後
発症後約10年で寝たきりとなり,全身衰弱や感染症などの合併により死亡する.
治療
治療は薬物療法と非薬物療法に大別される.介護サービスや家族支援の提供などを含む非薬物療法(ケア,リハビリテーション)が症状の軽減やBPSDの出現予防のために重要である.薬物療法は認知症に対する薬剤(抗認知症薬)とBPSDに対する対症療法(抗精神病薬の適応外使用など)に大別される.抗認知症薬ではコリンエステラーゼ阻害薬のドネペジル,ガランタミン,リバスチグミン,NMDA受容体拮抗薬のメマンチンが認可されている.これらは神経伝達を標的とする症状改善薬であり,疾患そのものの進行を阻止しえない.発症過程(図15-6-2)の上流に位置するアミロイドカスケード,それに続くタウ凝集過程を標的とした疾患修飾薬(βあるいはγセクレターゼ阻害によるAβ産生抑制,Aβ凝集阻害,Aβ免疫療法によるAβクリアランス促進,タウ蛋白リン酸化阻害,タウ蛋白凝集阻害など)の開発が活発に行われている.[山田正仁]
■文献
Ballard C, et al: Alzheimer’s disease. Lancet, 377: 1019-1031, 2011.
Jack CR Jr, et al: Introduction to the recommendation from the National Institute on Aging and the Alzheimer’s Association working group on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement, 7: 257-262, 2011.
出典 内科学 第10版内科学 第10版について 情報