改訂新版 世界大百科事典 「酸塩基」の意味・わかりやすい解説
酸・塩基 (さんえんき)
acid and base
酸と塩基の概念には幾多の歴史的な変遷があるが,基本的には水溶液中で水素イオンを増大させるものが酸で,水素イオンを減少させるものが塩基である,とすることができる。現在の考え方からすれば,酸や塩基というべきものはかなりの数が古くから知られていたが,酸や塩基という語や概念がふつうに用いられるようになるのは17世紀ないし18世紀ころからである。酸として最も古く知られているのは,発酵しすぎた酒や酢のような植物性の酸であって,酢はギリシア,ローマの著作や聖書,あるいは中国の史書などにも出てくる。もちろんその当時酸という概念があったわけではないが,〈酸っぱい〉を意味するラテン語acidusから〈酸〉を意味するacidという語がつくられたのである。日本では古来梅酢が多用されたという記録があるが,古くは硫酸は緑礬(りよくばん)精(緑バンを乾留するときに得られるものの意)などと〈精〉という語が用いられていた。1830年代になって宇田川榕菴がオランダ語のzuurを酸として用いたのが初めであるといわれる。錬金術時代になってミョウバンを蒸留して得られる〈ビトリオール油〉(現在の硫酸)や,ミョウバンと硝石の蒸留から〈強い水〉(現在の硝酸),塩とビトリオール油から〈塩精〉(現在の塩酸)などがつくられるとともに,安息香酸やクエン酸,酒石酸も見いだされ,これらが酸としてもっている性質や概念は17世紀ころにはすっかり固まってきて,酸という語がふつうに使われるようになってきている。すなわち,そのころの考え方として,〈酸とは,酸っぱい味をもち,植物色素の色を変える(スミレの花のしぼり汁やリトマスゴケの紫や青が酸で赤くなる)し,アルカリ(炭酸カリウムなど)や白亜(炭酸カルシウムなど)を溶かして気体を発生させ,金属を溶かす,という性質をもっているものである〉とされた。これに対して塩基という言葉はそれよりかなり後の18世紀半ばころから用いられ,〈酸と結合して固体の塩をつくるもの〉すなわち,塩の基という意味でbaseの語が使われるようになったものである。
18世紀も後半になると酸・塩基の概念はかなりはっきりしてきた。各種の無機酸,有機酸も見いだされ,塩基も確定してくると,これに対し統一的な概念を与えるための議論が行われるのは当然であって,A.L.ラボアジエは酸成分,アルカリ成分の分析などによって生ずる気体の研究から,酸には酸の素になるものがあって,これが酸素であるとした。この考え方は多くの人に支持されたが,酸素酸だけではなく水素酸のあることなどから否定され,19世紀に入ると,たとえばH.デービーやJ.J.ベルセリウスのように酸にはすべて水素が必要であるとして酸の水素説が主張された。そして1838年J.F.vonリービヒによって〈酸とは金属で置換できる水素を含む物質である〉と定義された。酸の水素説が確立されると,塩の定義も明らかになり,〈塩とは酸の水素を金属で置換したものである〉とされ,これから逆に〈塩基とは酸を中和して塩と水とを生ずるものである〉となったのである。したがって酸をHAとすれば,これを中和して塩MAと水をつくるもの,すなわち塩基はM2OないしはMOHであるということで,〈塩基とは酸根Aと置換できるOHをもつ物質である〉ということになった。このようにして19世紀の半ばころまでには,酸がH,塩基がOHとして定義されるようになったのであるが,19世紀終りころのS.A.アレニウスの電離説からすれば当然のように,〈酸とは水溶液中で水素イオンH⁺を与える物質であり,塩基とは水溶液中で水酸化物イオンOH⁻を与える物質である〉となる。この定義は20世紀に入ってからでもかなり長い間,無機化学の教科書に記されていたものである。この考え方をもとにして,1888年F.W.オストワルトは初めて酸の強弱を議論して,定量的な取扱いをすることを可能ならしめたのである。すなわち電解質の解離平衡に質量作用の法則を適用し,これによって多くのいわゆる弱酸,弱塩基の強さが考えられることになった。たとえば,酢酸のような弱酸HAは,水溶液中では
HA⇄H⁺+A⁻
のように解離するので,酸の強さは
Ka=[H⁺][A⁻]/[HA]
により,またアンモニアなどの弱塩基は
BOH⇄B⁺+OH⁻
のような解離をし,その強さは
Kb=[B⁺][OH⁻]/[BOH]
の値により決まる。すなわち酸の強さは[H⁺]の値(水素イオンの濃度)が大きいほど強く,塩基は[OH⁻]の値(水酸化物イオンの濃度)が大きいほど塩基性が強いということになる。このようになると,水素イオン濃度,水酸化物イオン濃度が注目され,とくに水のイオン積,すなわち
KW=[H⁺][OH⁻]
が重要になってくる。KWは19世紀の終りころ多くの人によって各種の方法で測定され,常温でほぼKW≒10⁻14(mol/l)2であることがわかってきた。このことから純粋な水,すなわち中性の水では,わずかに自己解離(H2O⇄H⁺+OH⁻)しており,したがって[H⁺]=[OH⁻]であり,それぞれ10⁻7mol/lであることになる。したがって[H⁺]>[OH⁻]のときが酸性,[H⁺]<[OH⁻]がアルカリ性ということになり,酸性であるかどうかは[H⁺]>10⁻7が目安となる。このことは20世紀に入って,酸塩基指示薬について詳細な研究を行ったセーレンセンS.P.L.Sørensen(1868-1939)によって導入されたpHの概念によって広く用いられるようになった。pHは-log[H⁺]をあらわす記号であり,[H⁺]=10⁻7であればpH=-log[H⁺]=7であるから,pH=7であることは中性,7以下で酸性,7以上ではアルカリ性であるということになる。この考え方は便利で,現在でもよく用いられている。ただしここでいう水素イオンは,最近では水溶液中では単なる水素の原子核としてではなく水和したオキソニウムイオンH3O⁺として存在していることも認められてきている。
水溶液中での酸・塩基
水溶液中でのH⁺の濃度あるいはpHをその水溶液の酸の強さとすることができるが,酸自身の酸の強さとしては,酸がH⁺を放出するものであるということからすれば,その程度すなわちKaがその酸の強さをあらわすことになる。Kaを酸解離定数,-logKa=pKaのようにしてpKaを酸解離指数といい,これによって酸性度をあらわす。Kbは塩基解離定数,pKbは塩基解離指数(塩基性度をあらわす)であるが,KbはKaと逆の関係にあるからKaあるいはpKaだけで,酸および塩基の強さをあらわすことができる。すなわちpKaの値が大きいほど酸性度は弱く(塩基性度は強く),小さいほど酸性度は強い(塩基性度は弱い)。たとえば弱酸といわれるHCN,H3BO3,CH3COOH,H2CO3などではそれぞれpKaが9.32,9.23,4.76,3.9であり,中程度の酸H3PO4,H2CrO4で2.15,0.74,強酸のHCl,HBr,HIなどでは測定できないほどであるが,推定値で-7,-9,-10などとされている。
酸がH⁺を放出するものであるといっても,その放出のしかたには各種のものがあり,一般に酸1分子当り放出するH⁺の数をその酸の塩基度といっている。
一塩基酸 HCl,HBr,HNO3,HOCN,HClO,HClO4
二塩基酸 H2CO3,H2SO4,H2S2O3,H2,CrO4,H2PtCl6
三塩基酸 H3PO4,H3[Fe(CN)6]
塩基については,H⁺を減少させるものであるから,1分子当りで減少させる数をその塩基の酸度という。
一酸塩基 NH3,KOH,NaOH
二酸塩基 Ca(OH)2,Ba(OH)2
三酸塩基 La(OH)3,[Co(NH3)6](OH)3なお,塩基度2以上の酸を多塩基酸,酸度2以上の塩基を多酸塩基という。
酸の種類
酸には,ハロゲン化水素(HF,HCl,HBr,HI)や硫化水素H2S,シアン化水素HCNなどを水に溶かした水素酸のような二元酸に対し,多元酸では,中心原子に酸化物イオンO2⁻の配位した陰イオンを成分とするオキソ酸(古くは酸素酸あるいはオキシ酸といった)が古くからよく知られている。たとえば,硝酸HNO3,過塩素酸HClO4,硫酸H2SO4,炭酸H2CO3,リン酸H3PO4などである。オキソ酸を基本として,中心原子にO2⁻のかわりにO22⁻の配位したものはペルオキソ酸,S2⁻ではチオ酸,F⁻,Cl⁻,Br⁻,I⁻,ではフルオロ酸,クロロ酸など,まとめてハロゲノ酸といっている。たとえば,ペルオキソ二硫酸H2S2O8,チオ硫酸H2S2O3,トリチオ炭酸H2CS3,ヘキサフルオロケイ酸H2SiF6,ヘキサクロロ白金(Ⅳ)酸H2PtCl6,ヘキサシアノ鉄(Ⅱ)酸H4Fe(CN)6などである。またオキソ酸のうち中心原子がO2⁻の橋架けによってつながった多核陰イオンをもつ酸の場合には,それらをまとめてポリ酸という。ポリ酸のうち中心原子が同種の原子の場合をイソポリ酸という。たとえば,二硫酸H2S2O7,二クロム酸H2Cr2O7,三リン酸H5P3O10,シクロ三リン酸H5P3O9,七モリブデン酸H6Mo7O24などである。異種原子が入った場合はヘテロポリ酸といっている。H2CrSeO7,H7Co2W12O42,H3PMo10V2O39,H3PW12O40,H6TeMo6O24などである。
酸・塩基の概念の拡張
水溶液中での酸・塩基の概念が確立され,現在に至るまでそれが実際に使われてきているが,現代化学の広範な分野すべてに通用するわけではない。科学はより統一的,より普遍的なものを求めるのが常である。20世紀になると,さらに統一的な概念が出現し,またそれぞれに確立したが,これには水溶液以外での反応,とくに非水溶媒系での反応の研究が進んできたことも原因の一つである。このなかでは1923年デンマークのブレーンステズJ.N.Brønsted(1879-1947)とイギリスのローリーT.M.Lowry(1874-1936)が独立に発表した概念と,アメリカのG.N.ルイスの概念がとくに重要である。
(1)ブレーンステズ=ローリーの概念 〈酸とはプロトンを供給する化学種であり,塩基はプロトンを受容するものである〉,すなわち酸HAの平衡を考えると,
HA⇄H⁺+A⁻
であるから,HAは酸であり,A⁻は塩基であると考えるのである。ここで重要なのは別に溶媒を水と限らなくてもよいことで,プロトン性溶媒のすべてに通用し,しかも先の水溶液中での場合をも含めていて,きわめて普遍的な定義である。たとえば実際には次のような場合がある。
酸 塩基
HNO3 ⇄H⁺+NO3⁻
HC2O4⁻⇄H⁺+C2O42⁻
NH4⁺ ⇄H⁺+NH3
H2SO4 ⇄H⁺+HSO4⁻
HSO4⁻ ⇄H⁺+SO42⁻
HCO3⁻ ⇄H⁺+CO32⁻
このときの酸と塩基の関係は互いに共役の関係にあり,酸に対しては共役塩基,塩基に対しては共役酸であるという。たとえば,HNO3のような強酸は,弱い共役塩基NO3⁻をもち,強い塩基のCO32⁻は弱い共役酸HCO3⁻をもつことになる。
(2)ルイスの概念 〈電子対受容体が酸であり,電子対供与体が塩基である〉,この考え方はきわめて広い範囲のものを含んで定義でき,しかもブレーンステズ=ローリーの概念も特別な場合として含むことになる。すなわちH⁺は電子受容体であるから酸であり,O2⁻,OH⁻,NH2⁻,NH3などは電子対を供与するので塩基ということになる。しかもプロトンがまったく含まれていないような場合でもすべて含めることができ,なによりも重要なことは溶液中での金属イオン(酸と考えられる)と配位子(塩基と考えられる)との錯形成反応を酸・塩基反応として考えることができることである。
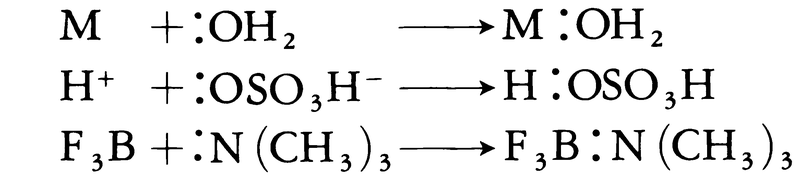
(3)溶媒系による概念 非水溶媒を中心として,溶媒が著しい自己解離反応をする場合にはすべて適用することができる。たとえば次のような溶媒系で,水の場合と同じように溶媒から生ずる陽イオン性化学種の濃度を増大させるような溶質が酸であり,陰イオン性化学種の濃度を増大させるものが塩基である。
2H2O⇄H3O⁺+OH⁻
2NH3⇄NH4⁺+NH2⁻
2H2SO4⇄H3SO4⁺+HSO4⁻
2POCl3⇄POCl2⁺+POCl4⁻
2BrF3⇄BrF2⁺+BrF4⁻
これは実際に上記の溶媒系でいわゆる酸・塩基反応を示すのであって,たとえばBrF3中では[BrF2][AsF6]は溶けて[BrF2]⁺と[AsF6]⁻となり,酸としての性質を示すが,KBrF4は溶けてK⁺と[BrF4]⁻となり,塩基としての性質を示し,
[BrF2]⁺[AsF6]⁻+K⁺[BrF4]⁻⇄K[AsF6]+2BrF3
のように中和してBrF3(溶媒)を生じ,塩のK[AsF6]を生ずる。これは酸あるいは塩基の性格が溶質の絶対的性質ではないことを示していて重要な考え方であるといえる。
(4)ルクス=フラッドの概念 水あるいはその他の溶媒をいっさい考えないで,乾式反応中で考えられる酸・塩基の概念としてセラミックスや冶金学その他の化学で重要である。たとえばCaOは水に溶ければCa(OH)2をつくるので塩基であり,CO2は水に溶けてH2CO3となるので酸である。しかし水がなくても
CaO+CO2─→CaCO3
のように,塩基のCa(OH)2と酸のH2CO3とから塩CaCO3をつくるのと同じである。すなわち固相と気相の上記の反応でも中和反応と考えてよいし,CaOは塩基性酸化物,CO2は酸性酸化物であるといわれるが,これらを塩基と酸と考えようというのである。すなわちルクスH.Luxは1939年,フラッドH.Floodは47年,乾式反応での酸・塩基として,酸化物イオンO2⁻供与体を塩基,受容体を酸と考える概念を発表している。ブレーンステズ=ローリーのH⁺を中心とした見方を,H2O⇄2H⁺+O2⁻からちょうど逆の考え方としているものと考えることができる。
(5)ウサノビチの概念 1939年ウサノビチM.Usanovichの提案による最も極端な考え方で,ルイスの概念をさらに発展させたものである。酸・塩基といっても酸化・還元といっても,つまりは物質を構成している粒子間の電子のやりとりにすぎないとして,〈酸は,陽イオンを与えるか,陰イオンと結合することのできる物質であり,塩基は,陰イオンを与えるか,陽イオンと結合できる物質である〉とした。これは酸化・還元まで手を広げて,統一的な概念としたものであるが,酸・塩基の概念をかえって混乱させるものとして,それほど広く受け入れられてはいない。
酸と塩基の硬さと軟らかさ
ルイスの概念でいえば,金属イオンあるいはそれに準ずるものが酸,配位子が塩基であるから,その錯形成反応の程度すなわち生成定数が重要な問題になってくる。錯生成定数を目安にするとき,配位子とくに配位原子による錯生成定数の大きさの順序がどうなるかによって次のように金属イオンを2通りに分類することができる。
クラス(a)金属:F>Cl>Br>I,
O≫S>Se>Te,N≫P>As>Sb
クラス(b)金属:F≪Cl<Br<I,
O≪S>Se>Te,N≪P>As>Sb
すなわち,クラス(a)金属は周期表の各属の最初の原子(F,O,Nなど)と,クラス(b)金属は各属の2番目以降の原子(Cl,S,Pなど)と最も安定な錯体をつくるものと分類した。1963年にピアソンR.G.Pearson(1919- )はこのような金属イオンの性格の特徴を,軟らかいsoftと硬いhardという概念にまとめ,さらに配位子すなわち塩基にまで広げて次のようにまとめている。
硬い酸 半径が小さく,酸化状態が高い,高い状態に励起される外殻電子がないイオンや分子。
軟らかい酸 半径が大きく,陽電荷は少ないかゼロ,励起されやすい外殻電子がいくつかあるイオンや分子。
硬い塩基 分極されにくく,電気陰性度が大きく,また還元されにくい陰イオンや分子。
軟らかい塩基 比較的分極されやすく,電気陰性度が小さく,また酸化されやすい陰イオンや分子。このようにすると酸塩基反応は,〈硬い酸は硬い塩基と結合しやすく,軟らかい酸は軟らかい塩基と結合しやすい〉という原則にまとめることができる。これはまた,硬いものどうしの結合はイオン性が強く,軟らかいものどうしの結合は共有性が強い,ということもできるということである。これは一般にHSAB則hard and soft acids and bases principleと呼ばれている。
執筆者:中原 勝儼
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報

