翻訳|ammonia
共同通信ニュース用語解説 「アンモニア」の解説
アンモニア
水素原子と窒素原子から構成され、燃やすと主に水と窒素になり、温室効果ガスの二酸化炭素(C〓(Oの横に小文字の2))は発生しない。燃焼を安定させることで有害な窒素酸化物(N〓(Oの横に小文字のX))の排出を抑えることができる。水素を液化するにはマイナス253度に冷やす必要があるが、アンモニアはマイナス33度で済む。船で大量輸送する際の費用が安くなる。
更新日:
出典 共同通信社 共同通信ニュース用語解説共同通信ニュース用語解説について 情報
日本大百科全書(ニッポニカ) 「アンモニア」の意味・わかりやすい解説
アンモニア
あんもにあ
ammonia
窒素と水素の化合物で、常温では無色、強い刺激臭のある気体である。化学式NH3。水によく溶け(体積で約1000倍溶ける)アンモニア水となる。
[中原勝儼]
歴史
古代エジプトの太陽神アモンAmonの寺院の近くから産する塩を「アモンの塩」sal ammoniacusといっていたが、当時食塩と尿とからつくられていた白色粉末(実は塩化アンモニウムNH4Cl)をさすようになり、このことばが転化して、のち、これから得られるものとしてアンモニアの名が生じた。1774年にイギリスのJ・プリーストリーが初めて合成に成功した。
[中原勝儼]
存在
大気中には少量存在し、天然水中にも微量存在することが多い。また土壌中には細菌による含窒素有機化合物の分解生成物として含まれている。これが井戸水などに含まれている場合には、腐敗物質の存在を示すことになり、飲料水として不適当である。なお、地球以外の惑星、たとえば木星や土星などの大気中にもその存在が認められ、宇宙空間でも存在することが確認されている。
[中原勝儼]
製法
工業的には窒素と水素とを加圧下、高温で反応させてつくる。実験室では市販の濃アンモニア水を加熱して、発生する気体を乾燥すると得られる。あるいはアンモニウム塩を水酸化カルシウムなどのアルカリと熱してつくる。これらの場合、塩基性のアンモニアガスを乾燥するのに、乾燥剤として酸性のもの(濃硫酸や五酸化二リン)、あるいは塩化カルシウムなどを使ってはならない(アンミン錯塩をつくってしまう)。通常は酸化カルシウムか水酸化ナトリウムを用いる。
[中原勝儼]
性質
常温では無色、特異臭を有する気体であるが、圧縮すると簡単に液体にすることができる(たとえば20℃ならば8.46気圧)。分子構造は三角錐(すい)形で、水素原子は正三角形(1辺163ピコメートル)をつくり、その中心から38ピコメートル高いところに窒素原子がある。この水素原子のつくる平面に対し、窒素原子が上下する振動があるため、原子時計に利用される。気体のアンモニアは空気中では燃えないが、酸素中では黄色の炎をあげて燃え、窒素と水とを生ずる。このとき触媒を用いて酸化すると一酸化窒素が得られ、これをさらに酸化して二酸化窒素とし、水で処理すると硝酸が得られるので、この反応は硝酸製造に用いられる。ナトリウムやマグネシウムなどの金属とは反応してアミドや窒化物をつくり、ハロゲンとは反応して窒素を遊離する。水溶液はアンモニア水といい、アルカリ性で、酸とは塩をつくり、各種の金属塩とは反応してアンミン錯塩をつくる。気体を液化したものを液体アンモニアといい、水によく似た性質をもつ無色透明の液体で、溶媒として用いられる。
[中原勝儼]
分析
気体中に含まれるときは、水または酸に吸収させ、水に溶けているときは、そのままネスラー試薬を加えると黄褐色になることによって存在が知られる。また、水溶液に水酸化ナトリウムを加えて熱すると、アンモニアの特異臭があることによって簡単に知ることができる。この臭気はきわめて強く、ごく微量でも(1立方メートル当り17ミリグラム)知ることができる。
[中原勝儼]
用途
肥料としてもっとも多く用いられ、その量は日本ではアンモニア全生産量の85~90%に達する。残りが工業用である。肥料としてはこれまで主として硫安に変えられていたが、最近では尿素として用いるほうが多くなっている。工業用としては、硝酸の製造、ソーダ灰(無水炭酸ナトリウム)製造のアンモニアソーダ法での使用、有機合成原料などとして用いられる。
[中原勝儼]
アンモニア水
アンモニアの水溶液をアンモニア水という。アンモニアを水に溶かしてつくるが、発熱するので冷却しつつ行う必要がある。濃度が高いほど比重が小さい。たとえば15℃のとき、アンモニア9.91%で比重0.960、19.87%で0.926、30.37%で0.898である。アンモニア水中でのアンモニア分子の状態は、種々の実験事実から水酸化アンモニウムNH4OHの存在は考えられず、水分子の付加したNH3・H2OとNH4OHの中間状態にあるものとされている。したがってアンモニアの水溶液を水酸化アンモニムのようによぶのは誤りである。無色透明の液体で、アンモニア臭と刺激性の味をもち、アルカリ性を示す。これは、
NH3+H2O NH4++OH-
NH4++OH-
の平衡によるものであるが、このときの平衡定数Kbは、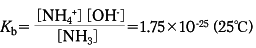
であって、弱アルカリ性である。熱した場合、もしくは、強アルカリが存在する場合は、溶解度が減少してアンモニアを失う。
沈殿剤、緩衝剤など試薬としての用途が重要であるが、衣類の洗浄や局所刺激剤、興奮剤、制酸剤、中和剤などの医薬品としても用いられる。
空気に触れさせておくと、揮発し、また空気中から二酸化炭素その他の酸性蒸気を吸収するから、ゴム、プラスチック、ガラスなどの栓で密栓して保存する。市販品は通常、空気中の二酸化炭素を吸収して一部が炭酸塩となっているので、厳密な目的のためには、水酸化バリウムを加えて煮沸し、出てくるアンモニアを、二酸化炭素を含まない蒸留水に溶かして使用することがある。濃アンモニア水は温度が上昇すると爆発的に噴出することがあるので、冷所に貯蔵する。とくに夏は栓をあけるとき噴き出すことがあるので、目に入れることのないように、十分注意しなければならない。
[中原勝儼]
液体アンモニア
アンモニアを液体にしたものを液体アンモニアという。略して液安ともいう。無色透明で、流動性が強く、水によく似た性質を示し、多くの各種化合物を溶解する。さらに電解質を溶かした溶液は、水溶液の場合と同じようなイオン反応、水素イオン濃度の変化による指示薬の変色などがみられる。このように各種化合物を液体アンモニアに溶かしたときには、水溶液中でおこす加水分解と同じように加溶媒分解をおこすが、これをアンモノリシスあるいは加安分解といっている。たとえば液体アンモニア中では、水の
2H2O H3O++OH-
H3O++OH-
に対応した
2NH3 NH4++NH2-
NH4++NH2-
があるため、重金属の塩類を液体アンモニア中に置くと、たとえば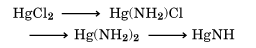
のような反応を示す。これはたとえば水中での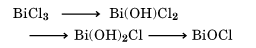
の加水分解に対応している。
また有機化合物が液体アンモニアだけでなく、アンモニア溶液と反応してアミノ基-NH2などが導入される場合もアンモノリシスということがある。たとえば、ハロゲン化物、酸無水物、エステルなどにみられる、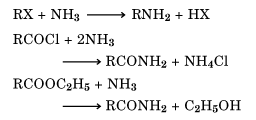
などがそうである。
液体アンモニアは、非水溶媒として種々の溶液反応の研究に用いられるほか、直接に肥料としても使われる。なお蒸発熱が大きいため古く冷凍用寒剤としても用いられたが、現在ではあまり使われていない。
取り扱う場合、粘膜を侵すので目、鼻、口などに直接触れないように注意する必要がある。
[中原勝儼]
『塩川二朗編『無機工業化学』第2版(1993・化学同人)』▽『金沢孝文・谷口雅男・鈴木喬・脇原将孝著『無機工業化学――現状と展望』(1994・講談社)』▽『渡辺明治・佐伯武頼編著『医科アンモニア学』(1995・メディカルレビュー社)』▽『日本化学会編『化学便覧 応用化学編』全2巻・改訂第6版(2003・丸善)』
アンモニア(データノート)
あんもにあでーたのーと
アンモニア
分子式 NH3
式量 17.03
融点 -77.7℃
沸点 -33.4℃
密度 気体、0.771g/L(0℃、1気圧)
(比重) 液体、0.817(測定温度-79℃)
結晶系 立方
溶解度 89.9g/100mL(水0℃)
改訂新版 世界大百科事典 「アンモニア」の意味・わかりやすい解説
アンモニア
ammonia
窒素と水素の化合物。化学式NH3。アンモニアの存在はその特異臭によって古くから人類に認識されており,古くは有機物のすす(煤),または塩化ナトリウムと尿とから昇華法によって,塩化アンモニウムNH4Clの形でつくられていた。アンモニアの名は,古代エジプトのアメン(ギリシア語ではAmmon)神殿の付近に産する磠砂(ろしや)(主成分は塩化アンモニウム)をアンモンの塩sal ammoniacusと呼んだことに由来する。人工的に初めてアンモニアをつくったのは1774年イギリスのJ.プリーストリーであるとされている。大気中に微量存在し,天然水中にも微量含まれることがある。窒素を含む有機化合物の発酵・分解の生成物として,土壌や汚水の中に含まれる(〈窒素〉の項目参照)。また,木星や土星の惑星大気成分の一つをなす。宇宙空間にも,星間物質としてアンモニア分子の存在することがマイクロ波によって確認されている。
性質
特有の刺激臭ある無色の気体。密度は0.771g/l(0℃,1気圧),空気の0.597倍で,拡散しやすい。圧縮,冷却により簡単に液化して液体アンモニア(工業的には液安ともいう)となる。気体は吸着,凝縮しやすい。固体は立方晶系で,融点-77.7℃。臨界温度132.4℃,臨界圧112気圧。水に対する溶解度は87.5g/100g(0℃),52.6g/100g(20℃),22.9g(50℃),エチルアルコールに対する溶解度は13.00g/100ml(15℃),エーテルにも可溶。気体は,空気中では燃えないが,酸素中では黄色の炎をあげて燃え,窒素N2を生ずる。
4NH3+3O2─→2N2+6H2O
ハロゲンとも反応して窒素を生ずる。たとえば,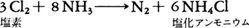
塩素が過剰に存在すると爆発性の三塩化窒素NCl3を生ずる。濃アンモニア水にヨウ素を作用させると,黒褐色の乾燥時爆発性のヨウ化窒素NI3・NH3粉末を生ずる。水溶液であるアンモニア水(工業的には安水ともいう)はアルカリ性を示す。酸と作用してアンモニウム塩を生ずる。陽性の大きい金属(たとえばナトリウムNa)上にアンモニアガスを通すとアミド(ナトリウムアミドNaNH2)を生ずる。
2NH3+2Na─→2NaNH2+H2
マグネシウムMgは高温で3個の水素原子を置換して窒化マグネシウムMg3N2を生ずる。
2NH3+3Mg─→Mg3N2+3H2
種々の化合物と付加化合物(アンモニア化物)をつくり,各種の金属イオンに配位してアンミン錯体を生ずる。たとえば,
AgCl+3NH3─→AgCl・3NH3(アンモニア化物)
Cu2⁺+4NH3─→[Cu(NH3)4]2⁺(アンミン錯体)
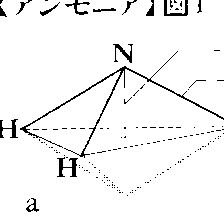
アンモニア分子は窒素原子を頂点とする三角錐構造で,三つの水素原子が底面で正三角形配置をとる(図1-a)。頂点の窒素原子は容易に底面の正三角形の中心を通り抜けて反転する(図1-b)。この両者の間の振動周波数は2.387013×1010Hzで一定しており,原子時計に利用される。
アンモニアはその特異臭によって鋭敏に検出され,17mg/m3の低濃度までの感知が可能である。水中の微量アンモニアはネスラー試薬の添加によって生ずる特異の濁り(黄色~黄褐色)により検出され,その含有量は飲料水としての適否の重要な指標になる。空気中のアンモニアガス含量は検知管によって迅速に定量することができる。
実験室における製法
実験室では,アンモニウム塩を水酸化カルシウムと混ぜ,加熱してつくる。
2NH4Cl+Ca(OH)2─→2NH3+CaCl2+2H2O
また,アンモニウム塩を強アルカリ水溶液と熱してつくることもできる。
NH4Cl+NaOH─→NH3+NaCl+H2O
アンモニアガスの乾燥は,よく煆焼(かしよう)した酸化カルシウムCaOの層を通して行う(塩化カルシウムはアンモニア化物CaCl2・8NH3をつくるのでアンモニアの乾燥剤としては使用できない)。
工業的製法
工業的には,古くはコークス工業における石炭乾留の際の副生アンモニアとして得られ,また,20世紀初頭に石灰窒素(カルシウムシアナミドCaCN2と炭素Cの混合物)の製造法が発明されたのち,アンモニア合成工業技術が確立・普及するまでの期間は,石灰窒素の水蒸気分解でアンモニアを取得し利用することも行われた。
CaCN2+H2O─→CaCO3+NH3
ただし,これらはアンモニア合成ではない。現在では水素と空気中の窒素とを原料として直接合成によって製造される。
20世紀はじめドイツの化学者W.H.ネルンストにより,
N2+3H2⇄2NH3
の化学平衡が本格的に研究された。この研究は純学術的視点のものであったが,F.ハーバーは,この反応によるアンモニア生成には高圧条件が必須であると見通して,その合成実験を成功に導いた。さらにイーゲー・ファルベン社において,K.ボッシュらが高圧装置を,ミタッシュA.Mittashらが触媒を,おのおの探究し,1910年代にアンモニア合成プロセスの完成をみた。これがハーバー=ボッシュ法Harber-Bosch process(IG法)である。その後,合成工程内の各条件にそれぞれ特色をもたせたクロードClaude法,カザレーCasale法,ファウザーFauser法,ウーデUhde法,NEC法,東工試法の諸法が30年ごろまでに出そろった。東工試(東京工業試験所)法は,日本独自の開発技術である。アンモニア合成技術完成後は,原料水素ガスの製造技術に工夫発明が加えられるようになった。現在のアンモニア合成法の名前は,水素製造技術を開発した企業名をつけて呼ばれるものが多い(テキサコ法,ICI法など)。
N2+3H2─→2NH3の反応は固体触媒によるガス合成反応であり,生成系であるNH3の収率は高圧低温ほど大きい(図2にそれらの関係を示す)。しかし低温では反応速度自体がおそく工業的に成立しない。適当温度に保つ必要がある。とくに高圧を採用したのはクロード法で,逆に低圧にする代りに高活性触媒(湿式調製)を用いるのがウーデ法である。他の方法は両者の中間型に属する。
アンモニア合成原料としての窒素は,空気の液化により得られるが,場合によっては空気をそのまま用いることもできる。水素の製造法自体は歴史的変遷が激しく,現在はナフサ・重油等の炭化水素資材を分解する方法が王座を占めているが,省資源の目的で原料の転換を考えることが重要課題となっている。
触媒としては,一般に酸化鉄(Ⅲ)鉄(Ⅱ)Fe3O4を主体とし,酸化カリウムK2O,酸化アルミニウムAl2O3等を添加した乾式調製の触媒が使われる。Fe3O4は屑鉄を酸素気流中で燃焼溶融してつくる。またFe3O4粉末を成形,焼結してつくるものもある。触媒粒子径は4~10mm,寿命は2~3年である。
アンモニア合成工程例の概略を次に示す。原料の窒素と水素を1:3(容積比)で混合する。精製後ガスを圧縮機に送り,合成時に必要な圧力まで高める。装置・動力コスト上から,圧縮機がアンモニア合成工程の心臓部といえる。高圧ガスは合成管(合成塔)に入り,一部がアンモニアに転化し,それを凝縮液化させて分離し,未反応分は循環して原料に戻す。合成管は転化炉とも呼ばれ,材質は特殊鋼(オーステナイト鋼)である。温度は400~450℃,圧力は250~300kg/cm2程度が標準である。
用途
化学工業の重要基本資材の一つで,ガス状,液状(液体アンモニア),水溶液(アンモニア水)の形で用いられる。工業用と肥料用に大別され,その消費量は,かつては肥料用が工業用より大であったが,1975肥料年度(7月1日~翌年6月30日)以降逆転している。工業用に使われたアンモニアが最後には回収されて肥料製品になる場合もある。工業用アンモニアから,アンモニウム塩(工業用塩化アンモニウム,炭酸水素アンモニウムなど),工業用尿素,硝酸,硝酸塩(硝酸アンモニウム,硝酸ナトリウムなど),亜硝酸塩などのアンモニア誘導製品がつくられ,液体アンモニア,アンモニア水と合わせてアンモニア系(ア系)製品と呼ぶ。さらにカプロラクタム,アクリロニトリル,メラミンなどの合成繊維・プラスチック原料の製造にも用いられる。肥料用としての最終製品は,窒素肥料(尿素,塩安(塩化アンモニウム),硫安(硫酸アンモニウム)など),化成肥料,肥料用アンモニア水・液体アンモニアなどである。工業用アンモニアの80肥料年度の用途別消費量の大小は,カプロラクタム>その他>尿素>アクリロニトリル>硝酸>発酵>メラミンの順である(その他とは工業薬品・鉄鋼・電力・医薬・冷凍・食品用など)。液体アンモニアは有用な非水溶媒としても用いられる。また,かつては製氷・冷凍用寒剤として使われていたが,フロンに取って代わられた。
取扱い上の注意
粘膜を著しく侵すから,目,鼻,口などに直接触れないよう注意する。また呼吸器に害を及ぼすから強く吸入してはいけない。高圧ガスボンベの色は白色。
執筆者:藤本 昌利+金澤 孝文
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「アンモニア」の解説
アンモニア
アンモニア
ammonia
NH3(17.03).大気や天然水中にも微量に存在するが,これらの多くは生物の排泄物,腐敗や分解の生成物などによる汚染起源のものであり,その存在は汚染されていることの指標とされる.実験室では,アンモニウム塩をアルカリとともに加熱して発生させる.工業的には,ハーバー-ボッシュ法で N2 と H2 から直接合成される([別用語参照]アンモニア合成).常温では無色,刺激臭のある気体.気体分子はN原子を頂点とする三方すい型構造で,N-H1.012 Å.∠H-N-H107°.融点-77.7 ℃,沸点-33.4 ℃.臨界温度132 ℃.水に易溶(52.0 g/100 cm3(20 ℃)),水溶液はアルカリ性を示す.酸と反応してアンモニウム塩を生じる.多くの金属に配位して,アンミン錯体を形成する.室温では安定であるが,約500 ℃ で分解して窒素と水素を生じる.高温では金属と反応してアミド,イミド,窒化物などをつくる.硫安,硝安,尿素などの窒素肥料や,硝酸,ナイロンなどの有機含窒素化合物の製造原料,炭酸ナトリウム製造,製氷などの冷凍機冷媒などに用いられる.アンモニア水は,アンモニアの水溶液である.水溶液中にはNH4OH分子は存在せず,
NH3 + H2O  NH4+ + OH-
NH4+ + OH-
という平衡があり,見掛けの塩基解離定数は,K1 1.81×10-5 である.28% の濃アンモニア水,10% の日本薬局方医薬品などが市販されている.液体アンモニアは比誘電率が高く(25(-77.7 ℃)),プロトン解離平衡が存在し,水に似た性質をもつ.[CAS 7664-41-7]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「アンモニア」の意味・わかりやすい解説
アンモニア
→関連項目ガス化学工業|空中窒素固定|石炭化学|石油化学|電気化学工業
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「アンモニア」の意味・わかりやすい解説
アンモニア
ammonia
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「アンモニア」の解説
アンモニア
世界大百科事典(旧版)内のアンモニアの言及
【化学工業】より
…以上の分類は,互いに重複している部分もあり,必要に応じて使い分けられている。 化学工業のうち素材型化学工業(石油化学,アンモニア,ソーダ工業など)の製品は,中間財であることが多く,製品の差別性に乏しい大量生産品であるのに対し,加工型化学工業(医薬品,化粧品,染料,塗料,農薬工業など)は,細かな用途に応じた多様な製品を生産している。前者は,大規模な装置を必要とし,操業度を高めることが企業経営上重要であるのに対し,後者では,新製品開発力やきめ細かい販売政策などが経営上重要である。…
【ガス化学工業】より
…ガスを原料とする化学工業のことであるが,一般には,天然ガスを原料として有機化学工業の中間原料であるメタノール(メチルアルコール),アセチレン,アンモニアなどを製造する分野をいう。ガス化学工業という分類は日本特有のものである。…
【排出】より
…たとえば海産硬骨魚類ではえらにある塩類細胞から,また海産爬虫類と鳥類では眼窩(がんか)や鼻腔にある塩腺から塩化ナトリウムNaClが体外に分泌される。 尿中に出される窒素老廃物はアンモニア,尿素,尿酸などであるが,動物がこのうちどれをおもに排出するかは,その動物がすんでいる環境,とくに水の利用状態と密接な関係がある。タンパク質が分解してできたアミノ酸の脱アミノ反応によってアンモニアができるが,これは毒性が強いため速やかに体外に出さなければならない。…
※「アンモニア」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...