翻訳|electrolyte
精選版 日本国語大辞典 「電解質」の意味・読み・例文・類語
でんかい‐しつ【電解質】
日本大百科全書(ニッポニカ) 「電解質」の意味・わかりやすい解説
電解質
でんかいしつ
electrolyte
水などの極性溶媒に溶かしたとき、イオンに解離して(これを電離という)、その溶液が高い電気伝導性をもつようになる物質を電解質という。
電解質溶液electrolytic solutionに電極を入れ、適当な電圧のもとで電流を通じると、電解質の成分イオンが電荷を失って両極に析出する現象を電気分解あるいは電解というが、電解質の名はこの現象に由来している。
[下沢 隆]
電離説
電解質溶液にイオンが存在していることは、イギリスのファラデーやドイツのコールラウシュらによって古くから指摘されていた。酸や塩基の水溶液についての中和熱や電気伝導度の測定値を説明するために、スウェーデンのアレニウスは、これらの水溶液中で未解離の溶質分子と、電離によって生じたイオンとの間に電離平衡が成立すると考えた。これが「電解質溶液は、電場をかけなくてもつねに一定の電離度で自由なイオンに電離している」という電離説で1887年に提出された。アレニウスの説あるいはイオン説ともいう。この考えによれば、電気分解の現象も、また電解質溶液における浸透圧、沸点上昇、凝固点降下などがモル濃度から期待される値より大きく現れることも説明される。電離説の欠陥は、イオンは互いに無関係に溶液中にあるとし、イオン間の静電相互作用を無視したことである。さらに、この理論は、ドイツのF・W・オストワルトやネルンストらによって定量的な形に展開された。
[下沢 隆]
電離のおこる原因
塩化ナトリウムNaClのような電解質塩類は、固体および溶融状態においても、その構成原子がイオンとして存在している。この種の電解質が極性溶媒中でイオンに解離しているのは、主としてイオン間の静電引力が溶媒の高い誘電率によって弱められることに起因している。これに対して、塩化水素HClのような分子は、普通の条件のもとでは共有結合の状態にあり、イオン結合性は小さいが、極性溶媒には溶けて、イオンを生成する。
HCl+H2O―→H3O++Cl-
この場合の電離は、生成したイオンの溶媒和(溶媒が水の場合は水和という)による安定化のエネルギーが大きいことに起因している。この種の電解質をとくに第2種の電解質ということもある。一般に、大きな溶媒和エネルギーを与え、かつ大きな誘電率をもつような溶媒では、電解質の電離は容易になる。極性溶媒の代表例は水であるが、ほかに液体アンモニア、過酸化水素、フッ化水素などがある。
[下沢 隆]
強電解質と弱電解質
電解質は、その構成イオンの種類や性質によって、さまざまに分類される。i価の正イオンm個とj価の負イオンn個からなる中性分子が次の電離を行うとする。
AmBn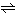 mAi++nBj-
mAi++nBj-
全体として電荷は中和しているのでmi=njであり、正・負イオンの存在比はイオン価に反比例する。このような電解質をi‐j価の電解質という。たとえば、塩化ナトリウムは1‐1価の電解質、硫酸ナトリウムNa2SO4は1‐2価、硫酸カルシウムCaSO4は2‐2価の電解質などとよぶ。また、電離した正・負イオンの数を考慮して、たとえばNaClは電離して正・負イオンを各1個生ずるので、一価二元電解質、Na2SO4を二価三元電解質などとよぶこともある。一般に電解質は溶液中で完全には電離していないので、電離の程度を電離度αを用いて示し、αの大きいものを強電解質strong electrolyte、小さいものを弱電解質weak electrolyteと分類することがある。
電解質塩類は一般に強電解質で、酸や塩基は強酸、強塩基から弱酸、弱塩基にわたってさまざまな電離度を示す。
[下沢 隆]
電離度
電解質総数に対する電離したイオンの数との比を電離度αという。αは0から1までの数字で、強電解質は1に近く、弱電解質は0に近い。またαは、濃度や温度によっても変化する。すなわち、濃度が低くなるほど、温度が上昇するほどαの値は大きくなる。
弱電解質でも、濃度が十分希薄になるとαは1に近づく。実験的にαはファント・ホッフ係数iの測定や電気伝導度の測定から求められる。たとえば、蒸気圧降下、沸点上昇、浸透圧などの測定からiを求め、次式によってαを求める。
α=(i-1)/(m+n-1)
ここでm、nはそれぞれ正・負のイオン価である。後者は比伝導度Λから求めた当量伝導度Λv(Λに1グラム当量の電解質を含む溶液の体積を掛けたもの)を種々の濃度で測定し、これを無限希釈した値Λ∞と比較する。αはΛv/Λ∞で与えられる。
[下沢 隆]
電離度と濃度の関係
電解質溶液を希釈していくと、電離度がしだいに大きくなる。電離しない電解質分子と電離したイオンとの間に電離平衡が成立し、質量作用の法則が適用される。この希釈度(濃度)と電離度の関係を表した法則がオストワルトの希釈律(単に希釈律ともいう)である。電離平衡の電離定数KはK=α2c/(1-α)で与えられるが、希釈度v(モル濃度cの逆数)を用いると、オストワルトの希釈率Kvが得られる。
Kv=α2/(1-α)
弱電解質溶液はこの式によく従うが、強電解質溶液では修正が必要である。
[下沢 隆]
強電解質の異常
強電解質の溶液や、高濃度の電解質溶液の場合、濃度cを用いた型の質量作用の法則の適用ができなくなり(これを強電解質の異常という)、Kcが濃度変化に対し定数でなくなる。このため濃度cのかわりに、有効濃度を導入する。いま、aを活動度、fを活量係数として、a=fcとする。cのかわりにこのaを用いると、電離定数が濃度に対して一定となり、質量作用の法則が保たれる。この考えは、アメリカのG・N・ルイスによって提唱された(1908)。
一方、オランダのデバイとドイツのヒュッケルは、まったく別の観点から強電解質溶液の性質を説明した。すなわち、強電解質溶液が希薄溶液では完全に電離していると仮定し、測定値の理論値からのずれは電離により生じたイオン間の静電相互作用によるものと考えた。すなわち、溶媒を均一な誘電体と考え、ある1個のイオンに着目し、その周辺の電荷分布を求める。つぎに、これにより生ずる静電ポテンシャルがマクスウェル‐ボルツマンの分布をしているとして、強電解質溶液内の浸透圧係数gを定義する。gはK、α、cなどと次の関係がある。

しかし、この理論も、イオンが水和している場合には理論値と実測値との一致が悪くなる。
[下沢 隆]
『日本化学会編『電解質の溶液化学』(1984・学会出版センター)』▽『大滝仁志著『イオンの水和』(1990・共立出版)』▽『玉虫伶太・高橋勝緒著『エッセンシャル電気化学』(2000・東京化学同人)』
改訂新版 世界大百科事典 「電解質」の意味・わかりやすい解説
電解質 (でんかいしつ)
electrolyte
物質を水に溶かすとき,その溶液が電気を通す性質(電気伝導性,導電性)を示す場合がある。これは,その物質が水の中で電荷をもった粒子(陽イオンと陰イオン)に解離することによる。このように溶媒に溶かしたときに,イオンに解離し導電性を示す物質を電解質という。イオンに解離する度合(解離度)は物質や溶媒によってさまざまである。普通は溶媒として水を用いることが多いので,水に溶かしたときに解離する度合の高い物質を強電解質strong electrolyteといい,解離の度合の低い物質を弱電解質weak electrolyteという。しかし,この分類は必ずしも正確とはいえず,むしろ解離の度合は物質の結合の性質に依存することから,つぎのような分類もなされる。液体または融解状態(高温下)で物質の導電性を調べてみると,導電性を示す物質(電解質)と示さない物質(非電解質nonelectrolyte)とに分かれる。融解状態で導電性を示す物質(融解電解質)は陽イオンと陰イオンによるイオン結合からなり,いわば〈真の電解質true electrolyte〉であり,いわゆる強電解質に相当する。たとえば塩化ナトリウムや塩化カリウムなどである。液体あるいは融解状態で導電性のない物質でも,それを溶媒に溶かすと,溶媒によっては導電性の生ずる場合がある。たとえば酢酸そのものは非イオン結合性であり,導電性はほとんどない。また酢酸を水に溶かしても弱解離する(約1%)にすぎない。しかし酢酸を液体アンモニアに溶かすと酢酸は強解離するようになる。これは,化学反応によりアンモニアが酢酸を分解し,アンモニウムイオンNH4⁺と酢酸イオンCH3COO⁻とが生じたことによる。酢酸のような物質はいわば〈潜在性の電解質potential electrolyte〉であり,いわゆる弱電解質に相当する。
電解質には,塩化ナトリウムNaClのように1価の陽イオンと1価の陰イオンからなる1-1型,塩化カルシウムCaCl2のように2価の陽イオンと1価の陰イオンからなる2-1型,硫酸マグネシウムMgSO4のように2価の陽イオンと2価の陰イオンからなる2-2型などの電荷型がある。電解質を溶かす溶媒としては水のほかに,液体アンモニア(沸点-33.4℃),液体シアン化水素(沸点+25.65℃)などのような無機物,酢酸,アセトン,アルコール,ジメチルスルホキシド,ヘキサメチルホスホルアミドなどの有機物がある。これらは水と同様に,誘電率の大きい溶媒,すなわち分子の双極子モーメントの大きい有極性液体である。電解質溶液についてはめっきや電池などの実用面から,また生理食塩水で知られているように医学的・生理学的な面から,さらに基礎的な面から物理化学的に研究がなされている。電解質溶液の理論としては,たとえば希薄溶液に関するデバイ=ヒュッケルの理論が知られている。電解質溶液の性質の特徴である導電性は当量導電率で表される。これは,電解質の1グラム当量を含む溶液の体積と,その溶液の比伝導度との積で,単位はcm2/Ωである。水中に電解質が溶けているかどうかを知る方法の一つとして,水質検査などで測定,利用されている。電解質の水溶液中では陽イオンと陰イオンがほぼ完全に解離する場合と,陰,陽イオンが静電的に作用しあって両イオンが対(イオン対)をなしていることがある。
水素イオンや水酸化物イオンを含まない電解質を水に溶かすとき,その溶液が(1)酸性を示す場合,(2)中性を示す場合,(3)アルカリ性を示す場合がある。(1)は陽イオンの電荷が2価,3価などのように高く,イオンの大きさが小さい場合に起こることが多い。アルミニウム塩やクロム(Ⅲ)塩(Al(NO3)3,Cr(NO3)3など)がその例である。(2)は食塩や塩化カリウムのように比較的陽イオンの大きさが大きな場合に多い。(3)はシアン化カリウムKCNのように陰イオンが水素イオンを取り中性の物質あるいはより電荷の低い陰イオンになりやすい場合に多くみられる。(1)(3)はいずれも,イオンが水を分解(加水分解)して酸性の原因である水素イオンやアルカリ性の原因である水酸化物イオンを生成することによって起こる。電解質を水に溶かすさいには加水分解という現象に留意する必要がある。
執筆者:橋谷 卓成
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「電解質」の解説
電解質
デンカイシツ
electrolyte
水などの極性溶媒に溶けて陽イオンと陰イオンに電離し,その溶液が電気伝導性を示すような物質.電離の結果,2個のイオンを生じるものを二元電解質(たとえば,NaCl),3個のイオンを生じるものを三元電解質(たとえば,CaCl2)などとよぶ.電解質は溶液中での電離の程度の大小により,強電解質と弱電解質とに分けられ,両者の性質には種々の差がある.強電解質は,塩類,無機酸,無機塩基などのように,相当濃厚な溶液においても,ほとんど完全に電離していると考えられる電解質であり,その電気伝導性は大きい.希薄溶液では,その当量電気伝導率は,濃度の減少とともに濃度の平方根に比例して増加し,無限希釈では極限当量電気伝導率に収れんする.また,強電解質の溶液は,オストワルトの希釈律のような希薄溶液に関する諸法則には従わない.強電解質の希薄溶液の熱力学的性質や電気伝導率などについては,電解質の完全解離とイオン間の静電的相互作用に基礎をおいたデバイ-ヒュッケルの理論とオンサガーの理論([別用語参照]オンサガーの式)によりよく説明される.一方,弱電解質は,多くの有機酸や有機塩基などがその代表例であるが,その電離平衡については質量作用の法則がよく成立する.ν+-ν-弱電解質では,濃度をc,電離度をα,解離定数をKとすれば,
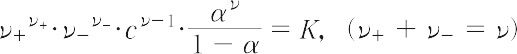
が成立し,Kは濃度に依存しないので,αは濃度の減少に伴って増大し,無限希釈では1に近づくことになる.また,電解質には,Al(OH)3やZn(OH)2などのように,酸性とアルカリ性の両方の性質をもつ両性電解質やタンパク質,ポリアクリル酸などの高分子電解質,安定化ZrO2を典型とする固体電解質などがある.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「電解質」の意味・わかりやすい解説
電解質【でんかいしつ】
→関連項目イオン|凝結|熱射病|非電解質|両性電解質
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「電解質」の意味・わかりやすい解説
電解質
でんかいしつ
electrolyte
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「電解質」の解説
電解質
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...