精選版 日本国語大辞典 「塩化マグネシウム」の意味・読み・例文・類語
えんか‐マグネシウムエンクヮ‥【塩化マグネシウム】
改訂新版 世界大百科事典 「塩化マグネシウム」の意味・わかりやすい解説
塩化マグネシウム (えんかマグネシウム)
magnesium chloride
化学式MgCl2。海水から食塩を製造するときの副産物である苦汁(にがり)に含まれ,これから取り出されるほか,岩塩鉱床に存在するカーナリットKCl・MgCl2・6H2Oを原料としても製造される。ふつう6水和物MgCl2・6H2Oとして存在するが,無水和物のほか2,4,8,12水和物も知られる。6水和物は潮解性をもつ無色,単斜晶系の結晶で,正八面体型の[Mg(H2O)6]2⁺イオンを含む。水溶液は非常に苦い。熱すれば塩基性塩を経て酸化物となる。
MgCl2・6H2O─→Mg(OH)Cl+HCl+5H2O
Mg(OH)Cl─→MgO+HCl
無水和物は酸化マグネシウムに炭素を加えて塩素と反応させるか,または水和物に塩化水素を通じながら加熱すると得られる。また塩化アンモニウムとの複塩MgCl2・NH4Cl・6H2Oを500℃に熱しても得られる。無色,六方晶系,塩化カドミウム型の結晶で,融点712℃,沸点1412℃,比重d25=2.32。吸湿性は6水和物よりさらに強く,20℃で100gの水に64.5g溶解する。アルコールにも可溶。マグネシウムの塩類の製造に用いられる。
執筆者:曽根 興三
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「塩化マグネシウム」の意味・わかりやすい解説
塩化マグネシウム
えんかまぐねしうむ
magnesium chloride
マグネシウムと塩素の化合物。無水和物のほかに、二、四、六、八、十、12水和物などがあるが、常温では六水和物(単斜晶系)がもっとも安定である。天然にはビショファイトMgCl2・6H2Oとして、ドイツのシュタッスフルトに産出し、複塩の形でカーナリットMgCl2・KCl・6H2Oとして産出する。海水中にも含まれ、イオン交換膜法製塩工業から出るにがりの中に10から20%程度含まれる。日本ではこれを原料として水和物を製造している。無水和物は酸化マグネシウムを直接塩素と反応させても得られるが、通常は水和物の脱水によっている。この場合、空気中で加熱すれば、たとえば次のような反応が一部でおこるので純粋なものが得られない。
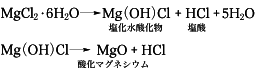
したがって、塩化水素気流中で加熱するとか、塩化アンモニウムを加えて脱水するとか、いろいろの方法がとられる。無水和物は無色の結晶性粉末で、吸湿性があり、水、アルコールに溶ける。金属マグネシウムやマグネシアセメントの製造原料として重要である。六水和物は無色の結晶で、潮解性で水によく溶け、エタノール(エチルアルコール)にも溶ける。水和物は豆腐の凝固剤、木材防腐、パーチメント紙の製造、羊毛の精製などに用いられる。
[鳥居泰男]
塩化マグネシウム(データノート)
えんかまぐねしうむでーたのーと
塩化マグネシウム
MgCl2
式量 95.2
融点 714℃
沸点 1412℃
比重 2.32(測定温度25℃)
結晶系 六方
化学辞典 第2版 「塩化マグネシウム」の解説
塩化マグネシウム
エンカマグネシウム
magnesium chloride
MgCl2(95.21).六水和物は天然にビショファイトとして産出する.塩化カリウムを析出させたカーナライトの溶液や,にがりからも得られる.工業的には酸化マグネシウムに炭素を加えて塩素ガスと反応させると無水物が得られる.実験室では,炭酸マグネシウムを塩酸に溶かしてから濃縮すると六水和物が得られる.無水物は無色の六方晶系.塩化カドミウム型構造.格子定数a = 0.622 nm.融点712 ℃,沸点1412 ℃.密度2.325 g cm-3.水に易溶,エタノールに可溶.六水和物は無色の単斜晶系.密度1.57 g cm-3.潮解性があり,水,エタノールに易溶.熱すると分解し,塩化水酸化物を経て酸化マグネシウムとなり,加熱により無水物は得られない.アルカリ塩化物と複塩をつくりやすい.金属マグネシウムの電解精錬,マグネシウム塩の製造,マグネシアセメントの原料,豆腐,パーチメント紙,消火器,陶磁器,繊維などの製造,塩析剤,医薬品などに用いられる.[CAS 7786-30-3:MgCl2][CAS 7791-18-6:MgCl2・6H2O]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「塩化マグネシウム」の意味・わかりやすい解説
塩化マグネシウム
えんかマグネシウム
magnesium chloride
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「塩化マグネシウム」の意味・わかりやすい解説
塩化マグネシウム【えんかマグネシウム】
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「塩化マグネシウム」の解説
塩化マグネシウム
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

