精選版 日本国語大辞典 「海水」の意味・読み・例文・類語
かい‐すい【海水】
- 〘 名詞 〙 海の水。ナトリウム塩、カルシウム塩を主成分とする多くの塩を含む無機電解質の水溶液で、含有成分の濃度は場所により異なるが、組成は一定している。うしお。
- [初出の実例]「紀伊国阿氐郡海水変如レ血。色経二五日一乃復」(出典:続日本紀‐天平三年(731)六月庚寅)
- [その他の文献]〔史記‐呉王濞伝〕
改訂新版 世界大百科事典 「海水」の意味・わかりやすい解説
海水 (かいすい)
sea water
地表近くにある水の総量のうち,約94%が海水として海にたたえられている。太陽系の惑星の中で,海水をたたえた海が存在するのは地球だけである。海水の全体積は1350×106km3程度,1年間の蒸発量は450×103km3程度であるから,全海洋水が蒸発によってなくなってしまうのに必要な時間,すなわち水が海洋中に滞留する平均時間は3000年程度である。水の蒸発量に見合う量の水が,降雨,河川からの流入,北氷洋や南氷洋からの氷のとけこみによって補われているため,海水の量には実際上,目だった急な変化は起こらない。
海水の起源
現在の海がどのようにしてできたかは,地球そのもののでき方やその歴史と密接に関連するもので諸説がある。大別すると,(1)誕生間もないころ(約46億年前)の地球は非常に高温であって,その周りには水素,酸素,窒素,塩素などの分子や化合物(気体)とともに水蒸気が存在し,地球の歴史の比較的初期に冷却凝集して現在の海の大部分を形成したとする説と,(2)地球は最初低温であったが重力圧縮や放射能の熱でしだいに加熱され,岩石中に含まれた水や塩素などの揮発性物質が火山ガスなどとして地球内部から地表に放出され,それらが徐々に蓄積して現在の海を形成するに至ったとする説とに分かれる。そして地球誕生からおよそ10億年ぐらいの間に生物が出現し,その光合成によって現在の大気に含まれる酸素や二酸化炭素の濃度を保つようになった。地質学的な証拠からは,大気や海水の量や化学組成は少なくとも過去数億年の間はほとんど変わらなかったと考えられている。
→地球
海水試料の採取
海水の物理的・化学的性質の深さや場所による違いを調べるには,まずそれらの測定に必要な海水を採取して実験室で分析しなければならない。表面にある海水は,船からバケツやポンプを使って容易に採取できる。しかし,数千mに及ぶ深海からその深さや水温が正確にわかる試料を他の海水と混合させずに,また目的とする成分に変化を与えずに採取することは必ずしも容易ではない。これまで通常の海洋観測では,1904年ノルウェーの海洋学者F.ナンセンの考案した採水器(ナンセン採水器)が世界的に最も広く用いられてきた。この採水器は,観測船のウィンチから繰り降ろすワイヤに適当な間隔に取りつけ,目的とする長さまで伸ばして採取するもので,1~2lの海水試料が得られる。水温はその採水器に取りつけた転倒温度計で読みとることができ,また正確な深さは海水に接した水銀温度計の圧縮率から計算される。これまでに得られている海洋観測データの大部分は,このナンセン採水器を用いて得られたものである。
近年では海洋の化学的研究の発展にともなって化学成分分析の要求が一層多様化し,より多くの試料を採取できる採水器が考案され,その結果,1970年代にはプラスチック製の採水器がナンセン採水器に代わって主流を占めるようになった。また,大量の海水試料を一度に採取できるものや,重金属の汚染を避ける特殊な採水器も開発されている。
→採水器
海水の化学的性質
化学組成
このようにして全世界の海から採取した海水を分析してみると,海水中に含まれる塩の量は場所や深さによっていくらか異なるが,主要な元素の濃度比は一定であるということがわかる。この事実は,19世紀の化学者たちの分析結果からしだいに明らかになり,1870年代のチャレンジャー号の航海で得られた各海域の海水試料についてのディットマーD.Dittmarの研究によってほぼ確立された。
海水1kg中に溶けている塩の量(g数)が塩分salinityであり,千分率(‰)で表す習慣になっている。外洋の海水の塩分は,33~38‰の範囲にある。このわずかな塩分の変動は,水の蒸発や海氷形成にともなう濃縮と,降水,河川水の流入,融氷による希釈などによって起こる。湾や沿岸海域では,海水の濃縮や希釈が激しく,外洋水の範囲をこえて極端に塩分が高かったり低かったりする場所もある。
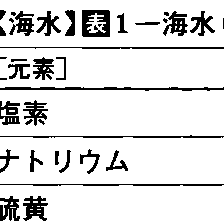
塩分35‰の海水に含まれる主要イオンの濃度(表1)をみると,ナトリウムと塩素が塩分の約80%を占めていることがわかる。主要イオンの組成は一定であるから,これらの主要元素濃度のいずれもが塩分と比例関係にある。そこで,実際に塩分を求める場合には海水中の主要成分を全部測定するのではなく,最も量が多く定量の容易な塩素イオン(臭素イオン,ヨウ素イオンを含む)を測定して比例係数を乗じて塩分を代表させる方法が,海洋観測の常法となっていた。すなわち,塩分Sは塩素量Clから
S(‰)=1.80655Cl(‰)
の関係式で求めた。塩素量とは,1902年の定義によれば,海水1kg中に含まれる塩素,臭素,ヨウ素の全量が塩素に置きかえられたときの塩素イオンのグラム数であり,1940年に328.5233gの海水中のハロゲンを完全に沈殿させるに必要な純銀の質量をグラム数で表したものと改訂された。
現在では,塩素量の定量よりさらに容易な海水の電気伝導度を塩分計を用いて測定することにより塩分が求められており,1978年以降,塩素量は塩分とは換算関係にない独自の要素として扱われている。この方法の原理は,一定の温度下で海水の塩分が高ければ高いほど,測定される電気伝導度が大きいことに基づいている。また,観測船から繰り出すケーブルの先端に装置を取りつけ,連続的に電気伝導度conductivity,温度temperatureおよび深さdepth(圧力)を測定するCTDシステムも盛んに使用されるようになった。
元素の溶存状態
いま1lの水に35gの食塩を溶かすと,海水に似た溶液ができる。純水が電気を通しにくいのに比べて,この溶液は電気をよく通す。これは食塩NaClが,荷電粒子すなわちナトリウムイオンNa⁺と塩素イオンCl⁻とに解離するためである。これらのイオンは,周囲に水分子を強く引きつけ溶液中に単独で安定に存在している。
2価のイオン,例えばマグネシウムイオンMg2⁺と硫酸イオンSO42⁻になると,溶液中で単独の水和イオンとして存在するとともに,イオン間に引きあう力が働いて接近し,見かけ上,電荷をもたない硫酸マグネシウムMgSO40となっている部分ができる。これをイオン対と呼んでいる。また,食塩水中に銀イオンAg⁺が入ると,銀イオンと塩素イオンとの間にイオン対よりも強固な結合の錯イオンAgCl2⁻ができる。このような無機錯体のほかに,金属イオンは溶液中で有機配位子と配位してキレート錯体を形成する場合もある。このように実際の海水中の元素は,さまざまな形態で存在していることが知られている。しかし,海水中の微量元素については,まだその存在状態が明らかになっていないものが多い。
酸性度
溶液の化学的状態を記述する上で重要な酸性度は,便宜上,水素イオン濃度(H⁺)の対数の絶対値をとり,pHで表すことになっている。現在の表層海水のpHは8.1で弱アルカリ性である。
この海水のpHを規制するのに重要なものは,二酸化炭素CO2,炭酸H2CO3,重炭酸イオンHCO3⁻,炭酸イオンCO32⁻および炭酸カルシウムCaCO3などの炭酸系物質である。大気中の二酸化炭素は,一方では動物の呼吸や有機物の燃焼によって放出され,他方植物の光合成によって取り込まれる。この二酸化炭素を水溶液に吹き込むと溶けた炭酸が解離して,pHを低下させる。この溶液に炭酸カルシウムを入れてかきまぜると,その溶解によって生じた炭酸イオンが炭酸の解離で生じた水素イオンと反応して重炭酸イオンを形成し,pHはふたたび上昇する。このように炭酸物質の解離・溶解反応によってpHが規制されることを緩衝作用という。この一連の反応を通して,大気の二酸化炭素分圧と海水のpHの間に一定の関係が存在する。現在,大気の二酸化炭素濃度300ppmでは25℃の海水のpHは8となり,実際の観測結果とよく一致している。
ただし,大気の二酸化炭素分圧が海水のpHを規制しているのか,また逆に海水のpHが大気の二酸化炭素濃度を規制しているのかということについては,論議は二つに分かれている。前者を支持する人は,大気中の酸素の場合と同じように,生物活動による二酸化炭素の生成と消費がほぼつり合って,過去から大気の二酸化炭素分圧が定常的に保たれてきたと考えている。後者を支持する人は,長石やカオリナイトなどの粘土鉱物との反応によって,海水のpHが独自に規制され,その結果として大気の二酸化炭素分圧が一定に保たれてきたと想像している。
酸化還元電位
海水中の元素の原子価状態を決めるに重要な酸化還元電位は,酸素分圧とpHによって決まる。現在の海洋水の大部分は酸素を含んでいて酸化的状態にある。したがって,海水中の遷移元素は通常,より高い原子価状態で存在する。
フィヨルドや黒海,あるいは閉鎖的な沿岸海域では,有機物の分解に酸素が消費されて海底付近の海水は無酸素状態になっている。また,有機物の多い堆積物中では,間隙水の硫酸イオンが還元されて硫化水素を生ずる。このような還元的状態では,鉄やマンガンは2価が安定で海水に溶けやすくなる。また一方,重金属の硫化物や炭酸塩が生成して堆積物に固定されたりする。
溶解度
いま海水に少量の食塩を加えても溶けるように,海水は塩化ナトリウムの溶解度に関して未飽和である。塩が飽和している状態では,その塩を構成するイオン濃度の積が一定であり,これを溶解度積と呼んでいる。海水の主要成分の濃度をそれらの塩類の溶解度(積)と比べたとき,海洋表層の炭酸カルシウムの場合を除いて,ほとんどが未飽和の状態にある。そこで,水を蒸発させて海水を濃縮していくと,溶解度積に達して硫酸カルシウムCaSO4,硫酸マグネシウムMgSO4,塩化カリウムKCl,塩化ナトリウムNaClなどの塩が順に沈殿してくる。
微量元素の場合にも,それらの最も不溶な固相の溶解度に比べて大部分が未飽和である。したがって,塩の溶解度からは,種々の元素が海水に溶存しうる最大濃度を知ることはできても,実際の海水中の濃度を見積もることはできない。
物質循環と地球化学収支
海洋は,大陸と海洋底を含めた地殻とともに地球表層を構成する一つの圏であり,物質が循環する場にすぎない。すなわち,海洋から蒸発した水は降水として地表に降下し,集合して河川となって風化物を海洋へ運び込む。海洋にもたらされた物質は,さまざまな変化を受けたのち堆積物として海洋底に蓄積する。この堆積物は,やがて海洋底プレートの動きにともなって大陸の下に運び込まれ,火山活動によってふたたび大陸の構成物質としてもどる。
河川によって毎年海洋に運び込まれる溶存物質の量は約36×1014gであり,粒子状の物質はその5倍程度といわれる。このように多量の物質が地質時代を通してたえず海に供給されてきているにもかかわらず,海水が塩類の溶解度に達しない原因は,供給に等しい量の物質が毎年海洋から除かれているためである。すなわち,海水中の元素の濃度を規制しているのは,海洋から元素を除去する過程である。1個の原子が海洋に供給されてから除去されるまでの時間を,海洋中の滞留時間という。定常状態にある元素の平均滞留時間は,海洋中に存在する量を,年間の供給量または除去される量で割って計算される。この平均滞留時間は,ナトリウムや塩素の1億年以上からトリウムや鉛についての数十年まで元素によって広い範囲の値をとる。一般に,元素の原子価が高くなるにつれて,また同じ原子価でも原子番号が大きくなるにつれて平均滞留時間は短くなる傾向がある。
海洋水は,その運動によっておよそ1000年に一度の割でゆっくりとかくはんされていると概念的に考えられている。それゆえ,平均滞留時間が1000年よりもはるかに長い元素は,除去されるまでの間に幾度もかくはんされて海洋中に比較的均一に分布する。海水の主要元素の組成が一定であることも,それらの平均滞留時間が非常に長いことから説明される。このような理由で,塩分と同じような分布をする成分を保存性成分と呼ぶ。海洋水の循環の時間に比べて滞留時間の短い元素については,その濃度は深さや海域によって変化し,また供給や除去の過程によっても左右される。
海洋水からの元素の除去過程はさまざまであり,元素によってはまだよく知られていないものもある。ナトリウムや塩素は,おもに堆積物の細かな粒子間に入り込んだ海水が閉じ込められて除かれる。このほかに,マグネシウムやカリウムでは海底の新しい玄武岩との反応で除去される過程も重要となる。カルシウムは,グロビゲリナなどの有孔虫やコッコリスなど生物の殻として,またケイ素の多くはケイ藻や放散虫の骨殻として取り込まれて海底に堆積する。ケイ素の除去は,粘土鉱物との反応によっても起こるといわれる。
生物過程と海水の化学
海水の流動とともに海洋中での物質を運ぶのに重要なものは,生物による取込みと分解の過程である。光が透過しうるのは海洋表層の100m以浅に限られ,炭素,窒素,リンなどの栄養塩を利用して光合成による一次生産が行われる。この植物プランクトンの成育が,さらに高次の生物過程の基礎となっている。このような生物活動の結果として生ずる物質,例えば動物プランクトンの排泄物や死骸などの粒子状物質は,その一部が重力沈降によって表層から深層へ運ばれ,深層水中や海底で有機物はバクテリアにより分解をうけ,生物性の炭酸塩やケイ酸塩は溶解をうける。その結果,海洋表層は栄養塩に乏しく,深層には多くなっている。そして,深層水の栄養塩が拡散や湧昇によって表層に運ばれることにより,海洋の生物生産性が保たれている。
このような海洋中での生物過程のサイクルには,栄養塩に限らず多くの微量元素も関与している。例えば,カドミウム,亜鉛,銅,ニッケルなどの重金属の鉛直分布は,栄養塩と類似の分布をしており,密接に関連していることが知られている。また,海水中で極端に濃度の低い鉄,マンガン,鉛,トリウムなどについても,粒子状物質に吸着して堆積物へ除去される過程がそれらの濃度を支配しており,海洋表層の生物生産性との関連も深い。
執筆者:野崎 義行
海水の物理的性質
海水は,液体としての一般的な特性である流動しやすい性質をもつ。このため,太陽からの熱放射の緯度による変化や風の影響をうけて,海水はたえず運動している。この運動には,例えばさざ波の発生にあたって表面張力が大きな役割を果たしているように,海水のいろいろな物理的性質が深くかかわっている。また,海氷の生成のような海の熱現象には,塩類を溶かしている溶液としての海水の物理的性質が大きい影響を与えている。
海水は,熱力学的には多成分系として扱われるべきものであるが,塩分の概念を導入して,単一溶質の溶液として近似的に取り扱うことが多い。例えば海水の状態方程式は,エッカートC.Eckartの実験公式によれば,
(P+P0)(α-α0)=λ
ここで,Pは1気圧を単位として表した水圧,αは比容(mg/l),P0=5890+38T-0.375T2+3S,α0=0.6980,λ=1779.5+11.25T-0.0745T2-(3.80+0.01T)S(Tは水温(℃),Sは塩分(‰))である。
海水の物理量のうち,保存性をもつもの,例えば塩分などは,特性量として重要である。保存性をもつとは,海水が熱的にも質量的にも周囲となんらの交換なしに移動したとき,その量が変化しないことを意味する。水温は,海水が断熱的に深さを変えると膨張または圧縮によって変化するため,保存量ではない。一方,海水をその深さから海面まで断熱的に移動させたときもつであろう水温は保存量であり,ポテンシャル水温と呼ばれる。塩分と同様に,海水の同定に用いられる。
海水中のイオンには,錯イオンの形で存在するものや水と結合した形で存在するものがあり,海水の分子構造は純水のそれとは異なる。海水の物理的性質を論じる場合,前述のように,一般には温度と塩分の関数として近似することが多いが,塩分の影響は温度の影響に比べはるかに小さく,純水で近似してもさしつかえない場合も少なくない。しかし海水の物理的性質のうち,電解質の存在が大きな役割を果たすものは,純水のそれとは大変異なる。例えば,海水の導電率は純水のそれの数万倍の大きさをもつ。
塩分の存在による,海水の諸特性と純水のそれとの違いは,次のとおりである。(1)1気圧の下で,純水では3.98℃で密度が最大となるが,海水では密度が最大となる温度は,塩分が高くなるほど低くなり,塩分35‰の海水では約-3.54℃である。海水の氷点は,塩類の溶解にともなう氷点降下の影響をうけ,例えば1気圧の下では塩分35‰の場合,氷点は約-1.93℃である。塩分24.5‰の海水では,氷点と密度が最大になる温度とが,1気圧の下ではほぼ一致する(約-1.36℃となる)。(2)1気圧下での熱膨張率は,純水の場合は3.98℃から0℃までの間で負の値をもち,したがってこの温度範囲では温度低下とともに水は膨張し,密度は小さくなる。塩分が24.5‰よりも高い海水では,熱膨張率はつねに正であり,したがって氷点まで温度が下がるとともに海水は収縮し,密度は大きくなる。これらの特性は海氷の生成と密接に関連している。例えば湖水などでは,氷点(0℃)に達した水はそれより高温(3.98~0℃)の水より軽く,表面から結氷が起こる。しかし,24.5‰以上の塩分をもつ海水の場合,冷却されると密度は氷点に達するまで温度降下とともに増大する。表面近くの海水が冷やされて海面下の海水より低温になると,表面下に沈み込んでしまい,表面には新たに氷点より高い水温をもつ海水が現れる。こうして海水全体が氷点に達するまで,海水は氷結しない(海氷)。(3)海水の圧縮率は40~45×10⁻12cm2/dynであり,純水のそれとあまり違わない。(4)定圧比熱Cpは,純水では温度とともに減少するが,塩分が25‰よりも高い海水では温度とともに増加する。ただし増加率は小さい。これと定積比熱Cvとの比Cp/Cvは1.00~1.02くらいで,純水のそれと大差はない。(5)海水の浸透圧は塩分とともに増加する。(6)海水の表面張力,粘性係数は,塩分が高くなると大きくなるが,その変化率は小さい。(7)海水の熱伝導率は純水のそれよりも低く,塩分35‰の場合,純水の値より数%低い。
光の吸収・散乱
海水は純水に比べ長波長の可視光と紫外線をよく吸収する。かつて地球にはオゾン層がなく,太陽光に含まれる生物に有害な紫外線が直接達しており,生物は海水中で発生したと考えられている。海水が青く見えるのは,太陽光中の長波長成分は吸収されてしまうのに対し,太陽光の短波長成分は水分子により散乱されるためであるといわれる。またプランクトンなどの微細粒子が浮遊していると,光が反射・散乱され緑色をおびることもある。光の吸収率は海域,季節などによって異なるが,澄んだ海であってもおおむね400mで暗闇となる。植物が光合成を行うのに十分な光量のある深さを受光層と呼ぶが,この深さは約80m以浅である。
温度の分布
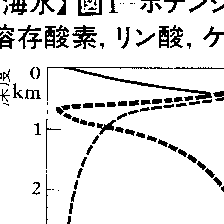
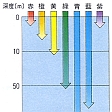
海水の温度は,季節,海域,深度によって変化するが,-2℃(氷点)から30℃程度の範囲にある(図2)。海洋では,太陽放射によるあたためられ方が緯度により異なるために起こる大規模な対流,および大規模な風系の作用による循環にともない,海水とともに熱も輸送され,緯度による温度差はそれほど大きくはない。海洋大循環では,大気の大循環におけると同様に流れは温度風に近いので,等温線を描くと流線に近いものとなる。水温は,一般に深度とともに低くなる。中・低緯度では数百~1000mの深さに,この温度低下が特に著しい層がある(図1参照)。これを主躍層という。このほか,夏期に表層に現れるもう一つの躍層は,季節躍層といわれる。
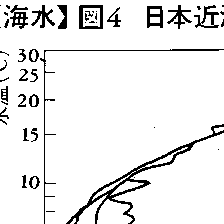
世界の海の海水の温度Tと塩分Sの組合せを作ると,それは決まった幾種類かに限定されていることがわかる。この組合せを水型と呼ぶ。また,ある地点で深さによる水型の違いを描くと1本の曲線が得られる。これをT-S図と呼ぶ。1本のT-S曲線は,ある点における1本の細い海水柱の中に含まれる,表面から海底までにわたる海水の特性を表しているといえる。世界の海の1本1本の海水柱についてT-S曲線を描いてみると,幾つかの限られた種類に分類できることが知れる。それぞれの特性をもつ水柱群を水塊という。例えば黒潮域では,海水柱のT-S曲線はほぼ一致する(図4)。
音の伝搬
音の伝搬速度Cは,海水の密度ρ,圧縮率κ,および定圧比熱Cpと定積比熱Cvの比γの関数として,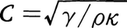 のように表される。ρ,κ,γはどれも海水の温度,塩分,圧力の関数として表されるので,伝搬速度Cもまた,これらの関数と考えることができる。海洋では,一般に水温は深度の小さい所ほど高温であり,また圧力は深度の大きい所ほど大きい。深度の変化による水温,塩分,圧力の変化が音速に与える影響をみると,浅層では水温が高いため音速が大きく,また深層では圧力が高いため音速が大きく,中層で音速が極小となる(図5)。したがって中層に音源を置くと,そこから斜め上方へ発射された音波の音線はしだいに下方向きに屈折してついに斜め下方向きとなり,また斜め下方へ発射された音波の音線はしだいに上方向きに屈折してついに斜め上方向きとなる。これから先での伝搬の仕方はこれらのくり返しとなり,結局,音波は音速極小層を中心とする層の中へ閉じ込められた形となって,遠距離にまで達する(図6)。電波伝搬における導波管のような役割を果たすこの層を,ソーファーチャネルと呼んでいる。
のように表される。ρ,κ,γはどれも海水の温度,塩分,圧力の関数として表されるので,伝搬速度Cもまた,これらの関数と考えることができる。海洋では,一般に水温は深度の小さい所ほど高温であり,また圧力は深度の大きい所ほど大きい。深度の変化による水温,塩分,圧力の変化が音速に与える影響をみると,浅層では水温が高いため音速が大きく,また深層では圧力が高いため音速が大きく,中層で音速が極小となる(図5)。したがって中層に音源を置くと,そこから斜め上方へ発射された音波の音線はしだいに下方向きに屈折してついに斜め下方向きとなり,また斜め下方へ発射された音波の音線はしだいに上方向きに屈折してついに斜め上方向きとなる。これから先での伝搬の仕方はこれらのくり返しとなり,結局,音波は音速極小層を中心とする層の中へ閉じ込められた形となって,遠距離にまで達する(図6)。電波伝搬における導波管のような役割を果たすこの層を,ソーファーチャネルと呼んでいる。
執筆者:寺本 俊彦
海水の工業的利用
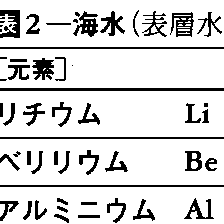
海水の工業的利用は,主として海水に存在する成分の利用に向けられている。現在では,塩,水(海水淡水化),マグネシウム,臭素などの資源が利用されている。なお,日本では,明治の末ころからにがり(苦汁)の工業的利用が行われてきた。海水淡水化については,1953年以来,アメリカの塩水局が中心となって広範囲の開発が行われてきた。日本では84年現在,離島の飲料水のほか,発電所用工業水を海水淡水化により造水している。マグネシウムは,海水中に1350mg/l含まれており,世界で200万t(1975)が海水から採取され,おもに耐火物であるマグネシアクリンカーの製造に使用されている。臭素は,海水中に60~63mg/l含まれており,海水に塩素ガスを吹き込んで採取している。生産量は,世界で年間数十万tと推定されている。日本では,年間1万t程度採取され,大部分は海水から,一部はにがりから製造されている。また,アメリカでは天然かん水,イスラエルでは死海の海水など含量の多い有利な原料から臭素を製造している。このほかの海水資源として,カリウム(380mg/海水l),ホウ素(4.6mg/海水l),リチウム(0.17mg/海水l),ウラン(0.003mg/海水l),重水などの採取が研究されている。とくにウランは,原子力エネルギーの燃料として注目され,世界各国で盛んに研究されている(海水ウラン採取)。海水資源の将来を展望すると,海水量は膨大(1.4×1018t)であり,あらゆる元素が存在することから,新技術の開発により未利用の成分を工業的に採取することも夢ではない。
近年,陸上の影響をうける沿岸海水については,生活排水,工場排水に起因した自然浄化能力をこえる環境汚染対策にも関心がはらわれている。このほか,海水溶存有機成分が間接的に魚類,海藻類の養殖に利用されている。海水溶存成分の利用のほか,海水は冷却水などにも工業的に直接利用されている。とくに日本のような周囲が海に接している国では海とのつながりは深い。
執筆者:増沢 力
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「海水」の意味・わかりやすい解説
海水
かいすい
sea water
海のもっとも基本的な構成要素。地球は表面付近に多量の水分を有するので、水惑星ともよばれる。地表付近の水は、海水、大陸氷、湖沼・河川水、大気中の水蒸気など種々の形で存在する。このうち海水が量的には圧倒的に多く、その体積は13億7000万立方キロメートル、重量は1兆4100億メガトンと推定され、地表付近の水の総量の98.3%を占める。広大な海洋表面から蒸発する水蒸気はやがて降水となり、直接、または地表を流れてふたたび海洋へと戻る。その周期はほぼ10日に1回の割合と見積もられている。地表付近の天然水は蒸発、降水、結氷、融氷などの過程を繰り返し、気相←→液相←→固相と形を変えて循環している。この水の動きが地表の気候を温和にし、降水をもたらして、地球上の生物環境を調整する役割を果たしている。
[秋山 勉]
海水の生成
地球表面に海水がどのようにして生成したかについては、いくつかの仮説がある。現在もっとも広く支持されているのは、地質時代における水の累進的生成によるとする説である。この説を要約すると、集積過程を完了した地球は内部が加熱され、地球内部の含水鉱物の水分が水蒸気として他の揮発性成分とともに地表に噴出した。地殻が冷却され、その表面温度が100℃以下になると、水蒸気は凝縮して水となって地殻の窪(くぼ)みにたまり始め、長い地質時代を通じて徐々に累積されて原始海水が生成した。この原始海水は強い酸性溶液であった。しかし蒸発と凝縮を繰り返すうちに地殻の玄武岩質と接触して、ナトリウム、カリウム、カルシウム、マグネシウム、鉄、アルミニウムなどの陽イオンを溶かし出し、海水は中和された。一方、火山や温泉活動により噴出する炭酸ガス(二酸化炭素)、塩酸ガス、亜硫酸ガス(二酸化硫黄(いおう))、窒素ガスなどが海水中へ溶け込み、陰イオンに相当する元素を供給した。この原始海水の生成は約30億年前であり、このころ海水中に生命の起源が誕生した。その後、海水中では物質の沈殿、溶解、変質などが繰り返され、生物活動の影響も受けて、約6億年前には現在とほぼ同様の海水が生成していたと考えられている。このように海水と大気は地球の生成当初には存在せず、地球の進化の過程で岩石中の揮発成分から徐々に生成し進化した、という考え方である。
地球の生成過程を推測する手掛りとして、化石など過去の遺物の年代決定、地殻や火山ガスの分析などの方法があるが、海水の生成についてもより正確な解明が期待されている。
[秋山 勉]
海水の物性
一般に海水の物理的性質は水温、塩分、圧力の影響を受けて変化する。海水が純水と異なる点は、その中に重量比で約3.5%の塩類を含んでいることである。したがってこの点を除いては、海水の物理的性質は基本的には純水の物理的性質が基礎となる。純水の物理的性質の一般的特徴としては、(1)比熱・熱容量が大きい、(2)高い沸点・融点を有する、(3)物質をよく溶かす、(4)表面張力が大きい、などがあげられるが、これらの性質は海水にも共通している。一方、密度、電気伝導度、浸透圧などは塩分の影響を大きく受けるので、海水と純水とでは大きく異なる。これは海水の特性といえる。
(1)密度 海水1立方センチメートルの質量のグラム数を海水の密度という。比重は4℃の純水の質量に対するその物質の質量比であるから、海水の場合には密度と比重は同じ数値となる。海水の密度は塩分、水温、水圧の関数であり、その海水が存在する場所でもっている密度を現場密度という。現場密度は1.000~1.031の比較的狭い範囲にあるので、便宜上、次式によって定義されるシグマ‐T(σt)を使う。式中のρst,pは深さ(P)の関数である。
σt=(ρst,p-1)×1000
たとえば塩分35psu(psuはpractical salinity unitの略、実用塩分単位)、水温20℃、圧力1気圧(海面)の海水を考えると、現場密度は1.02478でシグマ‐Tは24.78となる。海水の密度の測定は精密な浮き秤(ばかり)を使用して直接測定することもあるが、実際には定温・定圧下で海水の電気伝導度を測定して海水の塩分を求め、現場の水温・水圧を考慮して、計算により現場密度を正確に求める。海洋学において海水の現場密度は、力学計算により海流を算出するための重要な量である。
(2)水蒸気圧・沸点・氷点 海水の水蒸気圧は、同じ温度の純水に比べていくぶん低く、水蒸気圧低下の度合いは塩分に比例する。純水の沸点は100℃であるが、海水の場合には水蒸気圧が純水よりも低いために、沸点は100℃を超える。これを沸点上昇という。塩分35psuの海水の場合、100℃で水蒸気圧降下は水銀柱15.23ミリメートル、沸点上昇0.56℃となる。海水の結氷点は海水と氷の水蒸気圧が等しくなる温度で、海水の水蒸気圧が純水に比べて低いことから、0℃以下となる。これを氷点降下(凝固点降下)という。塩分35psuの海水の場合、結氷点は零下1.91℃となる。実際の海洋では、海水温が氷点に達しても結氷しないで過冷却の状態がみられることがある。
(3)浸透圧 海水は純水に比べて大きな浸透圧をもっている。その大きさは氷点降下量と一次的な比例関係にあって、塩分とともに増加する。塩分35psu、水温4℃の海水の浸透圧は約23気圧である。海洋生物は、細胞の半透膜を通じて浸透圧の差によって、海水との間で水分の交換を行っている。そのため海水の浸透圧は、海洋生物の生理作用と重要なかかわりをもつ。沿岸海域などで海水塩分の急変がおこると、生物は体内水分の多量の得失に対応できず、死に至ることがある。
(4)比熱 海水の比熱は純水に比べて低く、塩分が増加するにつれて低くなる。一定圧力下での定圧比熱と一定容積での定積比熱を区別して用いることがある。塩分35psu、水温17.5℃の海水では、定圧比熱は0.932となる。
(5)熱伝導度 熱伝導率は一般に流れる熱量と流れの方向の温度勾配(こうばい)の比で表される。純水も海水も温度の上昇とともに一次的比例関係で熱伝導度は増加する。海水の熱伝導度は純水に比べていくぶん低く、塩分35psuの海水では純水に比べて約4.2%小さい。
(6)電気伝導度 海水に溶けている塩類は、ほぼ完全にイオンに解離して電解質溶液となっているため、海水の電気伝導度は純水に比べて桁(けた)違いに大きい。電気伝導度は水温と塩分の関数であるが、海水の場合にはとくに塩分の増加とともに直線的に大きくなる。温度を一定にしておけば、海水の電気伝導度は塩分だけの関数となるので、海水の比電導度を測定して塩分を求める方法が広く実用化されている。
(7)粘性 静止している海水の粘性は水温の上昇とともに急激に減少する。この分子粘性は海水のほうが純水に比べてわずかに大きい。実際の海洋では海水が流動しているので、分子粘性よりもはるかに大きい渦(うず)粘性が重要である。
(8)表面張力 海水の表面張力は、水温が上昇すると減少し、塩分の増加とともに大きくなる。塩分35psu、水温20℃の海水の表面張力は1センチメートル当り73.5ダインとなる。生活排水として洗剤液などの表面活性物質が沿岸海域に流入しているが、このような場合には海面水の表面張力は著しく低下してしまう。
(9)光の屈折率 光が大気から海中に入射するとき、海面において進行方向を変える現象を光の屈折という。この現象は、大気と海水とでは光学的密度が異なり、光の進行速度が異なるためにおこる。境界面と入射光および屈折光との角度をi、rとすれば、屈折率nは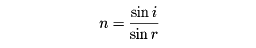
で表される。海水の屈折率は光の波長によってもわずかに変化するが、水温の低下や塩分の増加に伴って著しく大きくなる。海水の屈折率と水温、塩分の関係は実験的に精密に求められているので、水温を一定にして屈折率を正確に測定すれば、海水の塩分を求めることができる。
(10)音速 音波は海水中において空気中よりもはるかに速く伝搬する。また海洋中では光や電波に比べて吸収が少ないので、はるかに遠方まで到達する。この音波の伝搬特性を生かして海中通信、測深、魚群探査などの実用面でも広く音波が利用されている。海洋中の音波の伝搬速度cは、伝搬経路の水温t、塩分s、水圧pの関数で
c=1449.2+4.623t-0.0546t2
+0.1605p+1.391(s-35)
という式で表される。この式より明らかなように、海水中の音速は、水温の変動にもっとも大きく影響される。いま伝搬経路の水温が20℃、塩分35psu、水圧を1気圧(海面)とすれば、音速は毎秒1520メートルとなる。海洋中における音波の伝搬速度の変化や屈折などの特性を利用して、中層、深層の水温や海流の間接的な測定法が開発され、音波断層観測法とよばれている。
[秋山 勉]
海水の化学成分
海水中には重量比にして約3.5%の無機塩類が溶けている。これらの塩類は水中でほぼ完全にイオンに解離しており、海水は一種の電解質溶液ともいえる。海水1キログラム中に溶けている塩類の総量をグラム数で表した数値を海水の塩分といい、従来パーミル(‰)で表していた。1970年代になって、CTD(電気伝導度水温水深計Conductivity-Temperature-Depth profiler)などの測器によって、現場での水温、電気伝導度、圧力が測定されるようになり、これらの3要素の関数として塩分を表わす新しい定義が必要となってきたことから、無次元の数値psu(psuはpractical salinity unitの略、実用塩分単位)として新たに塩分が定義され、1982年から国際的に使用されている。海水中に溶けている塩類のうち、量的に豊富な11成分を海水の主成分といい、塩類総量の99.99%を占める。残りの0.01%を総称して微量成分という。このほか海水は酸素、窒素、炭酸ガスなどを気体の状態で溶存している。
(1)主成分 海水中の塩素やナトリウムなど11種類の量的に豊富な元素や基をいう。海水の塩分は場所や季節によって大幅に変化するが、主成分相互の存在比は世界中のどこの海水についてもつねに一定である。したがって主成分のうちのどれか一成分を定量すれば、ほかの主成分の量や塩分を知ることができる。事実、塩分を知るために塩素量を定量する方法が長年使用されてきた。1970年代になって海水の密度、電気伝導度、屈折率、音速などの物理量と塩分の間には、それぞれ精密な量的相互関係があることが確かめられ、これらの物理量測定が新しい塩分定量法として登場してきた。なかでも海水の電気伝導度測定は、精密で簡便な方法として広く実用化されている。
(2)微量成分 現在ではほとんどすべての元素が海水中に存在することが確かめられている。量的に比較的多い微量元素でも、海水1リットル中に10マイクログラム以下である。海水中の微量成分は海洋生物の栄養源となったり、海洋中の化学反応を促進するなど、量的には少なくても存在の意義は大きい。微量成分の存在量は主成分の場合と違って、海洋生物に利用されたりするため、場所や深さあるいは季節によって大幅に変動する。この特性から、微量成分の存在量や分布の状況などを解析して、水塊分析や生物生産性の調査などに利用する。
(3)溶存気体 海水は塩類のほかに、大気の成分である酸素、窒素、炭酸ガス、アルゴンなどを気体の状態で溶存している。海水の気体溶存量は水温、塩分によって決まり、これを飽和量という。海の表面近くでは、溶存気体は海面を通じての大気との交換によってほぼ飽和量に達している。溶存気体のうち酸素は、海洋生物の呼吸作用、有機物の酸化分解、海洋中の酸化還元反応など、海洋環境中の広範な物質循環に密接に関与している。炭酸ガスは、溶けている炭酸塩類とともに無機炭酸物質として海水中に共存しているが、光合成作用による海洋の有機物合成の基礎物質である。また、海面を通じての大気との炭酸ガス交換により、人為的影響で増加する大気中の炭酸ガス濃度変化を調整する役割をもっていて、1980年代以降は気候問題との関連でとくに注目されている。窒素は不活性元素で海洋中の化学反応にほとんど関与せず、海面から海底までほぼ飽和に近い一様な量が溶存している。
[秋山 勉]
海水の天然放射能
海水中には多くの種類の天然放射性物質が微量であるが存在する。主要な放射性核種はカリウム40Kで、海水の天然放射能の97%を占める。このほか、ごく微量であるがウラン238U,235U、トリウム232Th、ラジウム232Raなどの放射性核種が存在する。これらの系列で順次放射性壊変(崩壊)を繰り返して新しい核種を生成している。これらの放射性物質は、壊変によってその量が半分になるのに要する年月(半減期)が、数億年から数十億年と非常に長寿命である。炭素、水素の放射性同位体である14Cおよび3Hは、大気圏の上層で大気成分と宇宙線の核反応によって生成され、降水とともに海面に供給される。14Cはその半減期が5760年で、3Hは12年と比較的短いため、海水中のこれらの核種の濃度を正確に定量してその海水の年齢を決定する。その結果は海洋の大循環の研究などに利用されている。
[秋山 勉]
海水と生物
海洋中には大小さまざまの生物が生息している。これら海洋生物のうちで植物プランクトンや海藻類は、海水中の栄養成分を直接体内に取り込んで増殖することができる。海洋の表層に無数に存在する植物プランクトンは、その体内の葉緑素と太陽光線のエネルギーを利用し、光合成作用によって有機物を合成する。これが海洋の生物生産の基礎をなしている。増殖した植物プランクトンは動物プランクトンに、動物プランクトンは小形の魚類に、小形の魚類は大形の魚類にと次々に捕食されて、海洋全体の生物生産機構が成り立っている。一方、枯死した生物は、沈降しながらバクテリアなどによって腐敗分解され、無機の成分となってふたたび海水中に還元される。このように生物作用によって海水中のリン、窒素、ケイ素、炭素などの物質は、海水と生物の間を循環している。生物と無機物の中間生成物として、海水中には有機体の物質も溶存している。一般に海面近くの光合成層では、生物による取り込みのため栄養塩類の濃度は低く、深さとともに増加する。窒素やリンが表層で極端に少なくなると、生物基礎生産の制限因子となることがある。表層における光合成作用では炭酸物質を消費して酸素を生産し、枯死分解の過程では酸素を消費するので、海水中の溶存酸素は表層で多く、深さとともに減少して、ある深さで極小となる。海洋生物は栄養塩類のほか、海水中の重金属元素なども体内に取り込む。生物体内のこれらの元素の濃度が、環境海水中の濃度の数百倍、数千倍にも濃縮されることがある。放射性物質や有害重金属などの環境海水中の濃度が低くても、人間が食品とする場合には、海洋生物体内の有害物質の濃度にはつねに注意が必要である。
[秋山 勉]
海水の利用
海水を資源として利用することでは、従来主成分である食塩、マグネシウム、臭素などが採取されてきた。食塩は、現在では陸上鉱床の岩塩からの採取のほうが経済的に有利で、海水からの採取はあまり行われていない。1960年代なかば以降、海水の脱塩による水資源としての利用が、いっそう実用化される気運にある。海水中の微量成分は陸上の鉱物や岩石に比べてはるかに濃度が低く、経済的に採算がとれないので、ほとんど利用されていない。将来陸上の資源が枯渇するにつれて、ウランなど特殊な成分を海水から採取することも考えられよう。
さらに重要な側面は、海水がもつ種々のエネルギーの利用である。1970年代以降は化石燃料にかわるクリーンエネルギーとして、海洋エネルギー利用の技術開発が急速に進展している。海洋のエネルギー源としては波浪、海流、潮汐(ちょうせき)などの運動エネルギーや、海水温度差などによる熱エネルギーが利用される。波浪エネルギーは、海面に浮かべた浮体が波によって受けた力をエネルギーとして取り出す方式である。1979(昭和54)~85年には、山形県由良(ゆら)沖で波力発電装置「海明」により、海域実験とともに陸上送電の試験が行われた。海流エネルギーを効率よく利用するためには、黒潮のように流速が大きく、流軸が比較的安定した場所を選ぶ必要がある。そのため黒潮のもつ運動エネルギーの観測手法と解析、評価が、黒潮開発利用研究の重要な柱として進められている。潮汐エネルギーは、潮位の上昇を直接位置のエネルギーとして利用する方法と、運動エネルギーに変換された形の潮流を利用する方法とがある。ドーバー海峡のランスでは、最大潮位差13.5メートルを利用して潮汐発電所が実用運転に入っている。海洋表層の高温水と深層の低温水との温度差を利用してエネルギーを取り出す方式が、海水温度差発電ocean thermal energy conversion(OTEC(オテック))である。エネルギーの取り出し方式には、表層の温海水を低圧で蒸発させる方法、温海水の熱を利用してアンモニアなどの液体を蒸発させる方法などがある。深層の冷海水は蒸発させた気体の凝縮に使用される。表層と深層の温度差が20℃以上あることが必要であり、ほぼ30度以下の低緯度海域が対象となる。定常的にエネルギーを取り出す方法としてはもっとも有望で、日本ではサンシャイン計画、ニューサンシャイン計画、アメリカではOTEC計画として開発が進められている。海洋エネルギーは一般的に一次変換装置によって機械的エネルギーとして取り出され、その後二次変換装置によって利用目的に沿って電力その他の形に変換される。このため各種の海洋構造物が必要であり、一部は実海域で実験に使用されている。取り出された電力は利用地まで輸送されて陸上の電力網に組み込まれたり、現場で電力を使用する場合には、水素、アンモニア、メタノール(メチルアルコール)などの化学物質をつくるエネルギーとして考えられている。波浪や海流などはエネルギーの総量は莫大(ばくだい)であるが、エネルギー密度が比較的低く時間的にも変動するので、時間・空間的にエネルギーを蓄えて利用効率を高めるくふうが必要である。そのほか海洋エネルギー利用に関する経済性や環境に与える影響などが、広範に評価、検討されている。
[秋山 勉]
『堀部純男ほか著『海洋科学基礎講座10 海水の化学』(1972・東海大学出版会)』▽『阿部友三郎著『海水の科学』(1975・日本放送出版協会)』▽『ウィリアム・ルーベイほか著、竹内均訳『海水と大気の起源』(1976・講談社)』▽『寺本俊彦編『海と人類の未来』(1990・日本学術振興会、丸善発売)』▽『R・V・テイト著、三栖寛訳『海洋生態学入門』(1990・九州大学出版会)』▽『日本海洋学会編『海と地球環境――海洋学の最前線』(1991・東京大学出版会)』▽『日本海水学会・ソルトサイエンス研究財団編『海水の科学と工業』(1994・東海大学出版会)』▽『須藤英雄編著『海からみた地球環境』(1994・成山堂書店)』▽『寺本俊彦編著『研究者たちの海』(1994・成山堂書店)』▽『鈴木正弘著『海水エネルギー』(1994・東海大学出版会)』▽『地学団体研究会編、青木斌・井内美郎・井口博夫・加藤義久・末永和幸ほか著『地球の水圏――海洋と陸水』(1995・東海大学出版会)』▽『能沢源右衛門著『新しい海洋科学』改訂版(1999・成山堂書店)』▽『北野康著『大気・海洋の化学像形成と地球温暖化――地球環境における炭酸塩物質の発言』(2000・東海大学出版会)』▽『柳哲雄著『海の科学――海洋学入門』第2版(2001・恒星社厚生閣)』▽『石田祐三郎著『海洋微生物の分子生態学入門――生態学の基礎から分子まで』(2001・培風館)』▽『鈴木正弘著『エネルギーと海水』(2002・佐久書房)』▽『豊田恵聖監修、東海大学海洋学部編『改訂 宇宙から深海底へ――図説海洋概論』(2003・講談社)』▽『関根義彦著『海洋物理学概論』4訂版(2003・成山堂書店)』
百科事典マイペディア 「海水」の意味・わかりやすい解説
海水【かいすい】
→関連項目海洋
出典 株式会社平凡社百科事典マイペディアについて 情報
最新 地学事典 「海水」の解説
かいすい
海水
seawater
海洋にある水のことで,地球表層に存在する水の97%を占める。その総量は1.35×1018m3で,平均水深3,729mの海洋を形成する。海水は1kɡあたり35ɡ前後の塩を含み,Cl−・Na+・SO42−・Mg2+・Ca2+・K+を主成分として,その他あらゆる化学成分を溶かし込んでいる。Uなどは安定な溶存イオンをつくるが,それをつくらないFeやAlなどは地殻組成に比べてきわめて低濃度である。CO2は大気の50倍もの量が溶けている。海水は低温ほど重くなるので,冬の北大西洋極域で十分冷却された表面海水は海底付近まで沈降し大西洋を南下する。この深層水が南極海を経て北太平洋で浮上するまでに2,000年程度かかることが,海水中に溶存するCO2の放射性炭素年代をもとに推定されている。
執筆者:角皆 静男・蒲生 俊敬
出典 平凡社「最新 地学事典」最新 地学事典について 情報
ブリタニカ国際大百科事典 小項目事典 「海水」の意味・わかりやすい解説
海水
かいすい
seawater
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
化学辞典 第2版 「海水」の解説
海水
カイスイ
sea water
地球の表面の3/4近くを覆う水圏の大部分を占める海洋,およびそれを構成する海水の起源について,V.M. Goldschmidt(ゴルトシュミット)は次のように考えた.地球の歴史のある時期に,地球の表面で液体が発生しはじめると,ただちに水は蒸発,凝縮による循環を繰り返し,接触する岩石そのほかの物質から元素を溶出し,これが海水となる.陸水の影響のない海水の主要元素の含有量比は,世界中どこでも一定である(海塩組成一定の法則).海水は一種の無機電解質水溶液で,ほぼ3.3~3.7% の塩類を含む.海水の密度は1.02~1.03 g cm-3 の値を示す.そのほかの物理化学的諸数値(氷点,浸透圧,沸点,蒸気圧,電気伝導率,粘性など)は,塩分量や塩素量との関係で表される場合が多い.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
世界大百科事典(旧版)内の海水の言及
【海】より
…地球上の陸地以外の凹所に水をたたえ,全体がひとつづきになっているところが海(海洋)である。それを満たす水が海水で,その塩分の組成率は,世界中ほぼ一定している。海岸近くの入江や,浦,潟(かた)を海とするか湖沼と呼ぶかは,多分に従来の習慣によっている。…
【海水淡水化】より
…単に淡水化ともいう。海水中には1l当り約35gのナトリウムや塩素などの無機物が含まれていて,このままでは飲料水として使用できない。そこで海水しか水源がない船舶,離島,中東地区などの乾燥地帯では,いろいろの方法で海水から塩分を除き(海水脱塩),飲料水を製造してきたし,現在でも世界各地で数多くの海水淡水化プラントが建設され,飲料水,工業用水,農業用水などの製造が行われている。…
【産業用水】より
…漁業は湖沼や海がなくては成り立たないが,この場合の湖沼や海の水そのものは産業用水とはいわない(ただし,これらの水を引き入れて養殖などに使う場合,これを産業用水と呼ぶべきかどうかは明確にされていない)。 用水を大別すると淡水と海水とになる。日本の淡水資源の賦存量は,年間総降雨量から蒸発量を差し引いた約4500億m3/年と考えることができ,これに対して,現在使われている淡水の用水量は,概略して,年間,上水道140億m3,工業用水490億m3(うち10億m3は上水道より供給),農業用水550億m3,水力発電用水4000億m3程度となっている。…
【地球】より
…このほか南極の氷床の消長,大地震,地殻変動,地球の核とマントルとの間の電磁気的カップリングによっても自転速度に変化が生じる。海水と海底との間に生じる潮汐摩擦によって自転にブレーキがかかり,しだいに自転速度が減る現象を永年減速といい,1日の長さが100年間に約0.014秒ずつ長くなる。一方,月の公転速度も海水の引力によって減速され,ケプラーの第3法則に従って,地球と月との距離は3.3cm/年の割合で大きくなる。…
※「海水」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...