精選版 日本国語大辞典 「塩化アンモニウム」の意味・読み・例文・類語
えんか‐アンモニウムエンクヮ‥【塩化アンモニウム】
改訂新版 世界大百科事典 「塩化アンモニウム」の意味・わかりやすい解説
塩化アンモニウム (えんかアンモニウム)
ammonium chloride
肥料としての正式名称は塩化アンモニアで,塩安と略称。化学式NH4Cl。天然には,火山噴気孔付近に昇華鉱物鹵砂(ろしや)(〈どうしゃ〉とも読む)として産する。無色で,結晶は立方晶系。高温安定のα型,低温安定のβ型とγ型の3種の変態があり,転移点は184℃と-30.3℃である。α型は塩化ナトリウムNaCl型構造,β型とγ型は塩化セシウムCsCl型構造。337.8℃で昇華し,アンモニアと塩化水素に解離するが,温度を下げると再結合し塩化アンモニウムの結晶を生ずるので高純度精製に利用される。比重1.53(17℃)。わずかに吸湿性があり,苦味をおびた辛味がある。水100gに対する溶解度は29.4g(0℃),37.2g(20℃),77.3g(100℃)で,水溶液はほぼ中性であるが,煮沸するとアンモニアが一部逃げて酸性になる。エチルアルコール,メチルアルコールに難溶,液体アンモニア,グリセリンには溶ける。
実験室ではアンモニアと塩酸とを直接反応させてつくられ,昇華によって高純度品に精製する。工業的には,日本で開発された塩安ソーダ法により炭酸ナトリウムとともに製造される。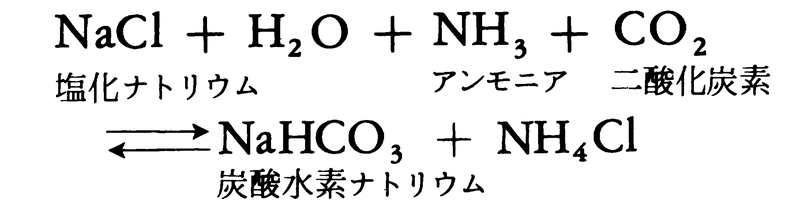
この反応式の生成系のNaHCO3分離母液から得られる。実際には,精製した工業塩を循環母液に加えて冷却しNH4Clを析出させる工程,CO2を吸収させて炭酸化を行いNaHCO3を析出させる工程の2種の晶出分離工程が繰り返され,その間に液組成調整のためのNH3吸収工程がある。
尿素とともに無硫酸窒素肥料の代表で,肥料公定規格ではアンモニア性窒素25%以上を保証する(NH4Clの理論値窒素26.2%)こととなっている。また化成肥料の窒素分原料にも使用される。肥料以外の用途としては,乾電池の電解液,亜鉛めっき,はんだ付け,染色,分析試薬,医薬品(去痰(きよたん)薬,利尿薬)などがある。
→炭酸ナトリウム
執筆者:藤本 昌利+金澤 孝文
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「塩化アンモニウム」の意味・わかりやすい解説
塩化アンモニウム
えんかあんもにうむ
ammonium chloride
代表的なアンモニウム塩の一つ。工業的には塩安とよばれる。
天然には火山噴出物や温泉の中にみいだされるが、工業的には、アンモニアソーダ法(塩安ソーダ法)で炭酸ナトリウム(ソーダ灰)を製造する際の副産物として生産される。
実験室ではアンモニアと塩酸の中和、硫酸アンモニウムと塩化ナトリウムの複分解などで得られる。無色の結晶性固体で、α(アルファ)、β(ベータ)、γ(ガンマ)の3種の変態があり、転移温度は184.3℃、および零下30.3℃である。高温では安定なα形は塩化ナトリウム型構造であるが、βおよびγ形は塩化セシウム型構造である。熱すると昇華して気体となり、塩化水素とアンモニアとに分解する。苦味を帯びた辛味があり、幾分吸湿性で、水によく溶ける。水溶液はほとんど中性であるが、加熱するとアンモニアが分離するので酸性となる。窒素肥料として大量に使用されるが、工業的にははんだづけ、めっきの際の表面清浄剤(フラックス)、乾電池の合剤、電解液の調製などに用いられる。分析試薬、医薬(去痰(きょたん)薬、利尿薬)としての用途もある。
[鳥居泰男]
塩化アンモニウム(データノート)
えんかあんもにうむでーたのーと
塩化アンモニウム
NH4Cl
式量 53.49
融点 -
沸点 -
比重 1.53(測定温度17℃)
結晶系 等軸
溶解度 37.2g/100g(水20℃)
昇華点 340℃
化学辞典 第2版 「塩化アンモニウム」の解説
塩化アンモニウム
エンカアンモニウム
ammonium chloride
NH4Cl(53.49).塩安,鹵砂(ろしゃ)ともいう.天然には火山の噴煙,鉱石,鉱泉中に存在する.塩酸にアンモニアガスを吸収させた後,濃縮して得られる.結晶は無色の等軸晶系.高温で安定なα形は岩塩型構造.格子定数a = 0.653 nm(250 ℃ 以上).βおよびγ形(低温)は塩化セシウム型構造.格子定数a = 0.3866 nm.転移点は184.3 ℃ および-30.5 ℃.密度1.53 g cm-3(25 ℃).340 ℃ で昇華し,アンモニアと塩化水素に解離する.苦味がある.水100 g に対する溶解度は29.4 g(0 ℃),77.3 g(100 ℃).エタノールに難溶,アセトン,エーテルに不溶.水溶液は微酸性を示す.電池製造原料,亜鉛めっきの融剤,染色用,ろう付け,はんだ付け,皮なめし,火薬原料,医薬品(去たん剤),分析試薬,窒素肥料として用いられる.多量に吸入すると危険である.[CAS 12125-02-9]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「塩化アンモニウム」の意味・わかりやすい解説
塩化アンモニウム
えんかアンモニウム
ammonium chloride
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「塩化アンモニウム」の意味・わかりやすい解説
塩化アンモニウム【えんかアンモニウム】
→関連項目窒素肥料
出典 株式会社平凡社百科事典マイペディアについて 情報
世界大百科事典(旧版)内の塩化アンモニウムの言及
【塩安】より
…肥料用塩化アンモニウム(肥料の正称は塩化アンモニア)の略称。1941~45年,朝鮮窒素の興南工場で約2万tの塩安が生産されたが,日本で本格的生産が開始されたのは50年以降のことである。…
【加水分解】より
…水による分解反応を広く加水分解といい,酢酸ナトリウムのような塩(えん)の加水分解,酢酸エチルのようなエステルの加水分解,デンプンやタンパク質の加水分解など,化学反応には加水分解の例が多い。強酸と強塩基との中和によりできた塩,たとえば食塩は,水に溶かすとナトリウムイオンと塩素イオンに電離するだけであるが,酢酸ナトリウムや炭酸ナトリウムのように弱酸と強塩基からできた塩,塩化アンモニウムや硫酸アルミニウムのような強酸と弱塩基からできた塩,さらに酢酸アンモニウムのように弱酸と弱塩基からできた塩は,それを水に溶かすと加水分解が起こる。酢酸ナトリウムCH3COONaは水溶液中で解離してCH3COO-とNa+になり,CH3COO-の一部は水と反応して酢酸分子CH3COOHとOH-を生ずる。…
※「塩化アンモニウム」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

