精選版 日本国語大辞典 「強酸」の意味・読み・例文・類語
きょう‐さんキャウ‥【強酸】
化学辞典 第2版 「強酸」の解説
強酸
キョウサン
strong acid
酸の強弱は,酸の定義,溶媒,相,また濃度,温度によって異なる.アレニウス酸は,水溶液中で水素イオン H+ を放出する化合物と定義されているから,水溶液中の電離度が高く酸解離定数 Ka が大きい,あるいは解離定数の逆数の対数値pKa (=-log Ka )の小さいものが強い酸で,一般に
pKa 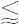 0
0
の,硝酸(-3),硫酸(pKa1 -2),塩酸(-8),臭化水素酸HBr(-9),過塩素酸(-10),ヨウ化水素酸HI(-11)など(( )内はpKa 推定値,pKa1 は解離段1).J.N. Brφnsted(ブレンステッド)の定義でも,酸はプロトン供与体であるから,溶媒が水の場合はアレニウス酸と同様に水溶液におけるpKa 値で判断できる.ただし,比較に用いるpKa は,標準状態25 ℃,イオン強度を一定に調整して活量係数が一定となる条件下の値である.オキソ酸の場合,中心原子の電気陰性度が高いほど強い酸で,たとえば過塩素酸H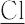 O4,硝酸H
O4,硝酸H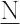 O3は強酸,炭酸H2
O3は強酸,炭酸H2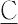 O3(pKa1 ,6.35),ホウ酸H3
O3(pKa1 ,6.35),ホウ酸H3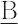 O3(pKa1 ,9.24)は弱酸(中心原子にアンダーライン).また中心原子の酸化数が高いほど強い酸で,たとえば次亜塩素酸HClO(7.53)はごく弱い酸であるが,過塩素酸HClO4(-10)は非常に強い酸である.誘起効果により解離するH原子との結合が弱くなるためと解釈される.水素酸ではH原子との結合が弱いHI(-11)がほかのハロゲン化水素酸より強い酸である.水溶液ではすべてほとんど完全解離で,強さの比較が困難な硝酸,塩酸,過塩素酸が,酢酸を溶媒にするとpKa 値が9.4,8.6,4.9の順になって過塩素酸がもっとも強い酸であることがわかる.液体アンモニア中では,アンモニアの陽子親和力PAが853.6 kJ mol-1 と大きく,酢酸も過塩素酸も等しく H+ をNH3に与えてNH4+を生じるから両者とも強酸で,水溶液中の強酸はすべて強酸である.溶媒を硫酸にすると,過塩素酸はきわめて弱い酸で,酢酸も硝酸も H+ を受容して塩基としてはたらく.したがって,このようなプロトン性溶媒中の酸の強さは,溶媒の酸としての強さとの相対的な関係で決まる.アセトニトリル,ジメチルスルホキシド(DMSO)などの非プロトン性溶媒でも,その溶媒中のpKa 値の大小で酸の強さを判断できる.DMSO中のpKa 値は,過塩素酸0.4,硝酸1.4でともに強い酸である.ルイス酸は電子対受容体であるから,一般的には求電子性の高い多価金属イオンやハロゲン化ホウ素BX3(X=ハロゲン)などが強酸である.気相中の酸の強さ(気相酸性度)は,直接,反応
O3(pKa1 ,9.24)は弱酸(中心原子にアンダーライン).また中心原子の酸化数が高いほど強い酸で,たとえば次亜塩素酸HClO(7.53)はごく弱い酸であるが,過塩素酸HClO4(-10)は非常に強い酸である.誘起効果により解離するH原子との結合が弱くなるためと解釈される.水素酸ではH原子との結合が弱いHI(-11)がほかのハロゲン化水素酸より強い酸である.水溶液ではすべてほとんど完全解離で,強さの比較が困難な硝酸,塩酸,過塩素酸が,酢酸を溶媒にするとpKa 値が9.4,8.6,4.9の順になって過塩素酸がもっとも強い酸であることがわかる.液体アンモニア中では,アンモニアの陽子親和力PAが853.6 kJ mol-1 と大きく,酢酸も過塩素酸も等しく H+ をNH3に与えてNH4+を生じるから両者とも強酸で,水溶液中の強酸はすべて強酸である.溶媒を硫酸にすると,過塩素酸はきわめて弱い酸で,酢酸も硝酸も H+ を受容して塩基としてはたらく.したがって,このようなプロトン性溶媒中の酸の強さは,溶媒の酸としての強さとの相対的な関係で決まる.アセトニトリル,ジメチルスルホキシド(DMSO)などの非プロトン性溶媒でも,その溶媒中のpKa 値の大小で酸の強さを判断できる.DMSO中のpKa 値は,過塩素酸0.4,硝酸1.4でともに強い酸である.ルイス酸は電子対受容体であるから,一般的には求電子性の高い多価金属イオンやハロゲン化ホウ素BX3(X=ハロゲン)などが強酸である.気相中の酸の強さ(気相酸性度)は,直接,反応
A- + H+ → AH
のΔH °およびΔG °の負の値で表され,数値が小さいほど強酸であることを示す.たとえば,
HI(1293.7) > HNO3(1329.6) > HBr(1331.0) > HCl(1373.0) > HF(1529.0)(( )内は kJ mol-1 単位の-ΔG °の値)
の順である.液相中の場合,溶媒和によるイオンの安定化エネルギーが加わるので気相中の順番と異なることが多い.酸水溶液で酸濃度がモル分率で0.5を超えると,イオン間の近距離相互作用による活量係数の増大や,溶媒である水の活量の低下がはたらいて,希薄溶液ではpKa が3.17で弱い酸であるHFの酸性度がHNO3より高くなり,
H2SO4 > HF > HNO3
の順となる.高濃度水溶液系,あるいは非水溶媒を含む系ではpHスケールを使えず,Ka も測定困難なので,Hammettの提案した酸性度関数H0 を用いる.- H0の値が大きいほど強い酸で,H2SO411.94,HF 11.03(298 K,それぞれ濃度100%)である.超強酸として知られるFSO3Hは15.07を示す.FSO3Hにルイス酸SbF5を加えると,さらに酸性度が上がり,SbF5のモル分率が0.9のとき26.5に達し,最強の酸と考えられる.[別用語参照]強塩基
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
栄養・生化学辞典 「強酸」の解説
強酸
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

