精選版 日本国語大辞典 「電気陰性度」の意味・読み・例文・類語
日本大百科全書(ニッポニカ) 「電気陰性度」の意味・わかりやすい解説
電気陰性度
でんきいんせいど
electronegativity
分子内で一つの原子がその原子自身に電子を引き付ける能力をいう。たとえば、2種の異なる原子からなる分子A―Bがあるとき、これらのAとBの原子の電気陰性度の差が大きいほど、結合にあずかる電子は一方の原子に引き付けられることとなり、結合のイオン性が大きくなる。これに対し、電気陰性度の差が小さくなり零に近くなるほど、電子は2原子に共有される度合いが大きく、共有結合性が強くなる。
電気陰性度の尺度を決めるには、種々の意見があり、実際にあうような考え方がいくつか提出されているが、次の三つの方法がもっともよく知られている。
(1)1932年、アメリカのL・C・ポーリングによって提唱されたもので、結合エネルギーを基にして計算されている。すなわちA―Bにおけるイオン性の寄与をΔABとしたとき、A―AやB―Bのような結合は同種元素間の結合であるから、イオン性は小さいとみなし、それぞれの結合エネルギーDAB,DAA,DBBの間には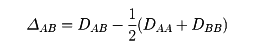
のような関係が成立すると考え、各種元素のΔABを求める。そしてこのイオン性の寄与が、AとBとの間の電気陰性度(それぞれχAおよびχBとする)の差に対応するものと考え、単位を電子ボルトeVに換算して、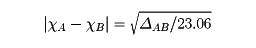
という式を満足させるようなχA、χBなどの値を求め、これを各原子の電気陰性度とする。これをポーリングの電気陰性度という。
(2)1934年、アメリカのR・S・マリケンによって提唱されたもので、各原子のイオン化ポテンシャルI(電子を一つ取り去るときに必要なエネルギー)と電子親和力E(電子を一つ付加するときに放出されるエネルギー)との和に関連した値をとっている。すなわち彼は、電気陰性度が分子内での二つの原子間のIとEとの平均値に比例することを理論的に証明した。この考え方はきわめて妥当なもので、その値もポーリングの電気陰性度と比べて3.15で割ったときほぼ対応した値となる。
(3)これらに対し、1958年にオールレッドAlbert Louis Allred(1931― )とロコウEugene George Rochow(1909―2002)が新しく提唱した実測による方法は、実際にあうものとしてきわめてよく用いられる。すなわち、一つの結合にある電子は、クーロンの法則によってZ*e2/r2(Z*はその電子に及ぼす有効核電荷)のような力を受けるが、これを実測の値と対応させて、電気陰性度χは、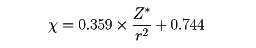
という式で表し、これからすべての元素の電気陰性度を求めている。
以上のような考え方からもわかるように、電気陰性度の値は、一つの元素についていえば結合する相手の原子が違えば変わってくるし、また分子構造が変わり結合状態が違ってくると変わるが、一般的にはもっとも普通の状態の値をとることが多い。現在多く用いられるのがオールレッド‐ロコウの値である。
[中原勝儼]
化学辞典 第2版 「電気陰性度」の解説
電気陰性度
デンキインセイド
electronegativity
原子が結合を通して電子を引きつけ,電気的に陰性になる度合をいう.電気的に陰性になる程度は,相手原子の種類によって異なる.任意の組合せに対してこの程度を予見しうるように各元素に固有な数値を与えたものが電気陰性度目盛である.電気陰性度目盛の定め方には,L.C. Pauling(ポーリング)(1932年)によるものと,R.S. Mulliken(マリケン)(1934年)によるものとがあるが,両者の目盛の間には一定の関係がある.AとBの原子からなる結合では,電気陰性度の差が大きいほど結合のイオン性は増大するから,結合エネルギーに対するイオン性の寄与 ΔAB(kcal mol-1)も大きくなる.Paulingは ΔAB がA-Bの結合エネルギー DAB とA-A,B-Bの結合エネルギー DAA,DBB の平均値との差で表されるとした.実験値から,
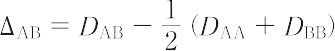
となる.種々の ΔAB を決定して,
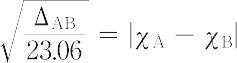
の関係ができるだけ満足されるように χA,χB を定め,これらをA,Bの電気陰性度とした.前式の根号内の値はeVに換算したものである.一方,Mullikenの考えによれば,共有結合性分子A-Bのイオン形式A+ B-の生成エネルギーは,Aのイオン化エネルギー IA とBの電子親和力EB の和,IA + EB で表され,同様にA- B+については,IB + EA で表される.したがって,AとBのどちらが電気的に陰性になるかは,
IA - EA = MA
などとするとき,MA と MB の大小で決められる.Mとχの間には,
MA - MB = 2.78(χA - χB)
の関係がある.Paulingによる電気陰性度の値を表に示す.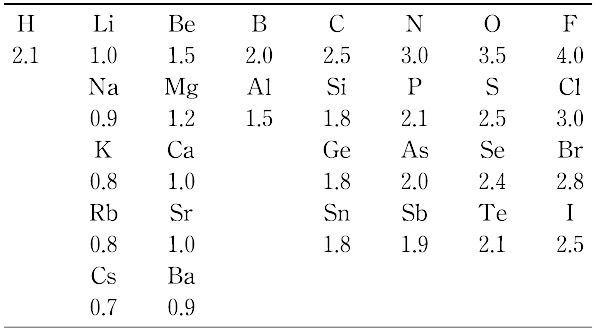 表の値より任意結合A-Bのイオン性は次式で求められる.
表の値より任意結合A-Bのイオン性は次式で求められる.
イオン性(%) = 16|χA - χB| + 3.5|χA - χB|2
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
改訂新版 世界大百科事典 「電気陰性度」の意味・わかりやすい解説
電気陰性度 (でんきいんせいど)
electronegativity
化学結合状態にある原子が,その原子の結合に関与している電子を引きつける度合を表す尺度で,値が大きいほど電子をよく引き寄せる。異なる原子A,Bの間の結合A-Bにおいて,AとBの電気陰性度に差があるとこの結合に関与する電子は一方に引き寄せられ,結合のイオン性が大きくなる。結合A-B,A-A,B-Bの結合解離エネルギーの実測値をDAB,DAA,DBBとすると,
⊿AB=DAB-(DAA+DBB)/2
はこのようなイオン性の尺度と考えられる。1932年L.C.ポーリングは種々の化合物の⊿ABを算出して,原子A,Bの電気陰性度ΧA,ΧBを,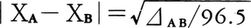 のように定義した(⊿ABはkJ/mol単位で表す)。このようにして決まった電気陰性度の値を通常の結合状態にある原子について表に示す。|ΧA-ΧB|>2のとき結合はイオン結合になることが多い。一方,R.S.マリケンは各原子のイオン化エネルギー(イオン化ポテンシャル)と電子親和力の算術平均をとり,これを結合状態の原子の電気陰性度の尺度とすることを提案している(1934)。この定義による数値はポーリングの定義による値と異なるが,両者の間にはよい相関関係がある。結合のイオン性の問題は,化合物の化学的性質ばかりでなく,たとえば半導体の電気的性質など物性とも深いかかわりがあり,その後も電気陰性度について種々の提案があるが,現在おもに用いられるのは上記二つの定義である。
のように定義した(⊿ABはkJ/mol単位で表す)。このようにして決まった電気陰性度の値を通常の結合状態にある原子について表に示す。|ΧA-ΧB|>2のとき結合はイオン結合になることが多い。一方,R.S.マリケンは各原子のイオン化エネルギー(イオン化ポテンシャル)と電子親和力の算術平均をとり,これを結合状態の原子の電気陰性度の尺度とすることを提案している(1934)。この定義による数値はポーリングの定義による値と異なるが,両者の間にはよい相関関係がある。結合のイオン性の問題は,化合物の化学的性質ばかりでなく,たとえば半導体の電気的性質など物性とも深いかかわりがあり,その後も電気陰性度について種々の提案があるが,現在おもに用いられるのは上記二つの定義である。
→化学結合
執筆者:木下 實
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
最新 地学事典 「電気陰性度」の解説
でんきいんせいど
電気陰性度
electronegativity
分子内の原子が電子を引きつける能力。この値はイオン結合と共有結合両方の性質をもっている化学結合のイオン性の程度を示す。二つの原子AとBの結合について,イオン共鳴エネルギーEr(eV)はA・B両原子の電気陰性度の差の二乗に等しい。したがってErを計算することによって電気陰性度を求めることができるが,この場合,基準になる元素の電気陰性度(x)に任意の数値を決める必要がある。xの絶対値は化学結合のエネルギーから求める。
執筆者:嶋崎 吉彦
出典 平凡社「最新 地学事典」最新 地学事典について 情報
百科事典マイペディア 「電気陰性度」の意味・わかりやすい解説
電気陰性度【でんきいんせいど】
→関連項目酸化数
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「電気陰性度」の意味・わかりやすい解説
電気陰性度
でんきいんせいど
electronegativity
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「電気陰性度」の解説
電気陰性度
世界大百科事典(旧版)内の電気陰性度の言及
【化学結合】より
…遷移金属イオンと青酸イオン,アンモニア,有機化合物の塩基類との錯化合物の結合は代表的なもので多数の例があるが,比較的簡単な化合物にもしばしばみられる。 水素結合は,電気陰性度の大きい窒素,酸素,フッ素などと共有結合している水素原子が,他の分子の陰性の原子との間につくる結合で,比較的弱い結合である。他の分子の塩基性が強くなると水素結合も強くなり,次に述べる電荷移動型の結合も寄与するようになるとされている。…
※「電気陰性度」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...