内科学 第10版 「Parkinson病」の解説
Parkinson病(錐体外路系の変性疾患)
定義
黒質緻密層ドパミン神経細胞の変性を主病変とし,緩徐進行性に運動4徴候(安静時振戦,筋強剛,無動,姿勢反射障害)を発現する特発性,進行性の疾患.一次性,二次性にParkinson病類似の症状を呈する他疾患が除外されることが必須で,ドパミン作動性治療が有効であることが参考になる.
歴史
1817年英国の医師James Parkinsonが6例の患者をshaking palsy(振戦麻痺)として初めて報告した.19世紀後半フランスの神経学者Charcotがこの疾患をParkinson病とよぶことを提唱した.疫学 通常孤発性であるが,家族発症例が約5%ある.わが国における有病率は人口10万人に対し110人程度,欧米白人の有病率はわが国の約1.5~2.5倍と高い.
病理
黒質緻密層のドパミン神経変性が最も顕著で,肉眼的に黒質の黒褐色の色調が失われ(図15-6-9),光顕ではメラニン含有神経細胞の変性脱落,グリア細胞の増殖がみられる.残存した神経細胞質のなかにエオジン好性の封入体(Lewy小体)が出現する(図15-6-10).青斑核にも同様の所見がみられる.Meynertの前脳基底核や迷走神経背側核にもLewy小体が出現する.
病態生化学
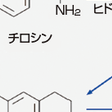
黒質緻密層のドパミン神経の変性によって,そのおもな軸索投射部位である線条体(尾状核と被殻)でドパミン(DA)含有量が著明に低下する.青斑核のノルアドレナリン神経の変性によって大脳皮質,視床下部など広範な脳部位でノルアドレナリン含有量が低下するが,線条体のDAの低下の程度と比べると軽い.図15-6-11にチロシンを出発とするドパミン,ノルアドレナリンの合成経路を示す.病態生理(図15-6-12) 大脳基底核はその回路の出口に相当する淡蒼球内節/黒質網様層(GPi/SNr)から視床に投射する抑制性(GABA作動性)の結合によって,視床の興奮性を調節し,視床を介して大脳皮質の活動性を調節している.一方,黒質緻密層から線条体への投射によって供給されるDAは線条体内に分布するGABA作動性ニューロンのDA受容体に結合するが,DAの作用は結合する受容体の性質によって興奮性(D1受容体)となるか抑制性(D2受容体)となるかが決まる.D1受容体を発現したニューロンは線条体から直接GPi/SNrに投射し,D2受容体を発現したニューロンは淡蒼球外節に投射し,淡蒼球外節から視床下核への抑制性投射(GABA作動性),視床下核からGPi/SNrへの興奮性投射(グルタミン酸作動性)を介してGPi/SNrの活動レベルを調節している前者を直接経路,後者を間接経路という.Parkinson病の場合には線条体内でDAが欠乏した結果,直接回路,間接回路を介してGPi/SNrニューロン(GABA作動性)は過活動状態となっており,その投射先である視床の活動を過度に抑制するため無動が生じると考えられている.
発症機序
孤発例の黒質細胞変性の原因は不明であるが,黒質細胞に選択的に作用する毒素の存在,細胞内で形成される活性酸素種による傷害,ミトコンドリア呼吸鎖の部分的異常によるエネルギー産生障害,などが仮説として提唱されている.また疫学調査からは,何らかの遺伝素因に環境要因が加わって発病するかどうかが決まると推測されている.また,近年の家族性Parkinson病の研究から,現在までに6個の原因遺伝子,すなわち,常染色体優性遺伝のPARK1:α-シヌクレイン(SNCA),PARK8:leucine repeat rich kinase 2 (LAAK2),常染色体劣性遺伝のPARK2:Parkin,PARK7:DJ1, PARK6:PTEN-induced putative kinase (PINK1), PARK9:P-type ATPase gene (ATP13A2)が明らかになっており,それらの機能解析から黒質細胞死の機序解明がはかられている.また,グルコセレブロシド(常染色体劣性であるGaucher病の原因遺伝子)の変異やLRRK2,SNCA,microtuble-associated protein TAU (MAPT)遺伝子の多型が遺伝的危険因子としてあげられている.臨床症状 発症年齢は50歳代後半から60歳代にかけてが最も多いが,20歳代から80歳代まで幅広い. 初発症状は一側性の,手指または足の震えが最も多い.そのほか,手指の巧緻性の障害,歩行時の足のひきずりなどで,症状に左右差があるのが特徴である.症状は片側上肢または下肢から始まり,緩徐に進行して,反対側の上下肢が侵され両側性となる.症状の進行後も病初期からの症状の左右差は残る.
臨床徴候として運動症状の4大徴候(安静時振戦,歯車様固縮,無動,姿勢反射障害)と自律神経症状,精神症状があげられる(表15-6-2).
安静時振戦は4~6 Hzの規則的な震えで,随意運動により減弱ないし消失する.歯車様固縮は検者が他動的に患者の関節を伸展・屈曲して筋を伸張するときに反射として生じる抵抗で「ガクガクガク」と細かい断続的な抵抗として感じる.手関節で最も検出されやすい.無動は動作数が少なくなり動作の速度も遅くなる現象をいう.小声,小書字,ボタンかけなど指の巧緻動作拙劣,歩行時の腕振りの欠如,瞬きの減少,仮面様顔貌,流涎(唾液の嚥下回数の減少による),寝返りや起き上がり動作などの体位変換動作,なども無動症状の現れである.姿勢反射障害は歩き出すと途中から次第に小走りになったり,前方や後方に軽く押されただけで,体勢が立て直せず倒れてしまう現象をいう.図15-6-13にParkinson病患者の屈曲姿勢を示す.自律神経症状では便秘が代表的(約70%)で脂漏性顔貌がそれにつぐ.精神症状としては患者の約40%にうつ傾向が,また約20%に認知機能低下が合併する.ただし認知機能低下が初発症状や主症状になることはない.
検査成績
一般血液・脳脊髄液検査には異常はない.CTやMR画像では疾患特異的な異常はない.近年,MIBG([123I]メタヨードベンジルグアニジン)心筋シンチグラフィ検査で観察される末梢交感神経終末の機能低下がLewy小体の出現する病気に特異性が高く,ほかのパーキンソニズムとの有力な鑑別手段となりつつある.
診断
診断は特徴的な臨床経過,左右差のある臨床症候と,ほかのパーキンソニズムを起こす疾患の除外によって確定される.l-ドパ(レボドパ)ないしドパミンアゴニストが有効であることが参考になる.
鑑別診断
変性疾患ではあるがParkinson病とは異なる疾患,症候性にパーキンソニズムを起こすおもな疾患のうち鑑別上重要な疾患を表15-6-3にあげた.頻度的に重要なのは薬剤性と脳血管障害性である.薬剤性パーキンソニズムを起こしやすい薬剤も表中に示した.
脳血管障害でパーキンソニズムを起こすものはラクナ状態と大脳の虚血性白質脳症である.両者とも鑑別上,画像が参考になる.前者は線条体を中心としたMRIのT1強調画像の低信号,T2強調画像の高信号の病変の集合がみられる(図15-6-14).後者はMRIのT2強調画像で大脳白質にびまん性の高信号域がみられる(図15-6-15).いずれも,Parkinson病と比べ筋固縮や無動は目立たず,振戦はないか,あっても不規則な姿勢時振戦が多い.症状の左右差は目立たず,歩行障害(小股・開脚歩行)が顕著である.錐体路症候や把握反射などの前頭葉徴候を伴うことが多い.虚血性白質脳症では痴呆の合併が多い.
多系統萎縮症のうち黒質線条体変性症では病初期の症候だけでParkinson病と区別するのは難しい.l-ドパの効果が十分でなく病気の進行が速い場合や振戦が動作時にみられ細かく不規則な場合にこの病気を疑う.進行性核上性麻痺は病初期からの転びやすさ,眼球の上下方向への注視麻痺を鑑別点にする.Parkinson病と比べて,本症では頸部の筋緊張は強いが,四肢の筋強剛は軽い.汎発性Lewy小体病は,大脳皮質にも広範にLewy小体と老人斑が出現する病気であるが,若年発症する病型では症候上もl-ドパに対する反応からもParkinson病と区別しにくい場合がある.しかし老年期に発症するものでは,病初期から精神症状が主体で,変動する高度の認知機能障害,幻覚など精神症状がみられる.大脳皮質基底核変性症は,パーキンソニズム以外に,失行,失認,など頭頂葉皮質症状を呈することが特徴で,固縮や無動に際だった左右差がある場合この病気に留意する.また画像上も大脳皮質および白質の萎縮に左右差が目立つ.
治療(図15-6-16)
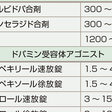
Parkinson病の治療に使用される薬剤と作用機序を表15-6-4にまとめた.これらの薬を組み合わせて治療する.Parkinson病の主治療薬として,ドパミンを補充する薬剤(l-ドパ製剤)とドパミン受容体刺激薬(ドパミンアゴニスト)がある.l-ドパは脳内で芳香族-l-アミノ酸デカルボキシラーゼにより脱炭酸されてドパミンとなる.ドパミンアゴニストは直接ドパミン受容体に結合してドパミン様の作用を表す. l-ドパは,最も有効率が高く安全性の高い薬剤であるが,血中半減期が約1時間と短く,病気が進行してくると,運動合併症(後述)が発現しやすいという欠点がある.一方,ドパミンアゴニストはl-ドパと比べると長時間作用するが,効果が弱く,悪心・食欲不振などの消化器症状や精神症状など副作用頻度が高い.l-ドパはどの病期の患者にも有効であるが,ドパミンアゴニストは進行例では単独で治療維持することは難しく,早期例・軽症例に適している.ドパミンアゴニストで治療導入すると,その期間l-ドパの開始時期が遅くなるので,運動合併症発現時期を先送りできることになる.
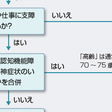
治療開始時期は患者が社会生活や日常生活に不便を感じているかどうかを参考に決める(図15-6-16).
治療を開始するに際して,主治療薬であるl-ドパ,ドパミンアゴニストのうち,どちらを用いるかは,患者の年齢,認知症の有無,患者の社会的背景を考慮して決める(パーキンソン病治療ガイドライン,2011).薬の用量と種類の組み合わせは,患者の症状をみながら漸増し,患者が活動するうえで必要な最適量を決める.治療開始時に留意すべき副作用は,ドパミン作動性薬剤による悪心,嘔吐,食欲不振が最も多い.薬剤を少量からゆっくり増量したり,制吐薬(ドンペリドン,モサプリド)の一時的併用によって防ぐことができる.
病気の進行とl-ドパの長期使用によってさまざまな問題が生じることがある.薬剤誘発性のジスキネジア(口周囲,舌,四肢などの舞踏病様不随意運動,ジストニアなど)や,精神症状(幻覚・妄想など)などがそれである.これらが出現した場合は原則として薬用量を減量して対応する.また病気の進行に伴いl-ドパの薬効時間が短縮し,症状の日内変動が生じるようになる.これをwearing off現象というが,この場合はl-ドパの服薬回数を多くしたり,ドパミン受容体アゴニストを併用する.また歩き始めや方向転換時に足がすくみ,しばらく足が踏み出せない「すくみ足」とよばれる症状が生じることがあるが,これにはドロキシドパの投与が有効なことがある.
予後
l-ドパ治療の導入後予後は大幅に改善され,発症後15年間は一般人口と生存曲線に差がないとする報告もある.ただし発病後8年経過した時点では病気の進行により,日常生活に部分介助が必要な患者が約30%となる.一般に若年発症者の方が高齢発症者より病状の進行が遅い.症状では固縮,無動が軽く,振戦の目立つ患者の方が経過がよい.[近藤智善]
■文献
孤発型Parkinson病.神経内科ハンドブック第4版(水野美邦編),pp 938-958,医学書院,東京,2010.
日本神経学会監・「パーキンソン病治療ガイドライン」作成委員会編:パーキンソン病治療ガイドライン2011,医学書院,東京,2011.
出典 内科学 第10版内科学 第10版について 情報