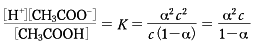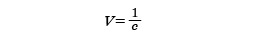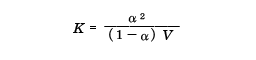オストワルトの希釈律
おすとわるとのきしゃくりつ
Ostwald dilution law
電解質溶液の希釈度(濃度)と電離度との関係についてドイツのF・W・オストワルトが1888年にみいだした法則。単に希釈律ともいう。電解質溶液を希釈していくと、水に溶けた電解質分子が電離してイオンになる度合い(電離度)がしだいに大きくなる。電離していない電解質分子と電離したイオンの間には平衡(電離平衡)が成立し、質量作用の法則が適用される。これが希釈律である。たとえば、酢酸の場合、これを水に溶かすと、酢酸分子の一部はイオンになり電離平衡に達する。
CH3COOH H++CH3COO-
H++CH3COO-
質量作用の法則を適用すると([ ]は濃度を示す)、
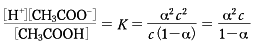
あるいは
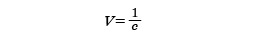
のVをとって希釈度とよび
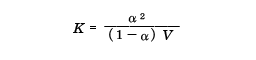
と表すこともある。ここでKは電離定数、cは電解質濃度、αは電離度を表す。オストワルトはα=Λ/Λ∞(無限に希釈したときの溶液の電気伝導度をΛ∞、ある濃度のときのそれをΛとする)としたときに相当するK=Λ2c/Λ∞(Λ∞-Λ)が、弱電解質の希薄溶液の実験結果とよくあうことをみいだした。
[戸田源治郎・中原勝儼]
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
改訂新版 世界大百科事典
「オストワルトの希釈律」の意味・わかりやすい解説
オストワルトの希釈律 (オストワルトのきしゃくりつ)
Ostwald's dilution law
溶液中における電解質の電離平衡についてF.W.オストワルトが提出した法則(1888)で,〈質量作用の法則〉を電離平衡に適用したものである。それによると,たとえば2個のイオンに解離する弱電解質MAの電離平衡
MA⇄M⁺+A⁻
において,溶液の希釈度をV,電離度をαとすると
α2/(1-α)V=K
の関係が成立する。ここでKは,温度と圧力とをきめれば一定の定数であって,これを電離定数electrolytic dissociation constantという。
執筆者:玉虫 伶太
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Sponserd by 
オストワルトの希釈律
オストワルトのきしゃくりつ
Ostwald's dilution law
2個のイオンに電離する弱電解質水溶液の濃度を c (単位 mol/l ) とし,この弱電解質1モルのうちαモルが電離するとき,それぞれのイオンの濃度は cα ,未解離の弱電解質の濃度は c(1-α) となるから質量作用の法則を適用すれば α2/[(1-α)V]=K で表わされる定数 K を得る。ただし V は 1/c ,温度は一定とする。オストワルトの希釈律は,濃度に関係なくこれらの関係式が成立するという法則である。α,K ,および V をそれぞれ電離度,電離定数,希釈度という。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by 
オストワルトの希釈律
オストワルトノキシャクリツ
Ostwald dilution law
弱電解質の希薄溶液における溶質濃度cと解離度αの関係を与える古典的法則で,
k = α 2c/(1 - α)
の右辺が溶質濃度に無関係に一定であること.F.W. Ostwald(オストワルト)が1885年に見いだした.しかし,この式では溶質および解離で生じたイオンの活量係数を考慮していないので,定数kは熱力学的に正しい平衡定数ではなく,したがって濃度とともに若干変化する.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
百科事典マイペディア
「オストワルトの希釈律」の意味・わかりやすい解説
オストワルトの希釈律【オストワルトのきしゃくりつ】
単に希釈律とも。電解質溶液の希釈度(溶質1モルが含まれる溶液の体積をリットルで表した数)Vと電離度αとの間にα2/(1−α)V=Kの関係が成り立つという法則。Kは温度一定ならば電解質の種類によらず一定で電離定数という。1888年W.オストワルトが発見。質量作用の法則を電離平衡に適用して得られる。弱電解質の希薄溶液ではよく合うが,強電解質溶液の場合には成立しない。
出典 株式会社平凡社百科事典マイペディアについて 情報
Sponserd by 
 H++CH3COO-
H++CH3COO-