精選版 日本国語大辞典 「イオン結晶」の意味・読み・例文・類語
日本大百科全書(ニッポニカ) 「イオン結晶」の意味・わかりやすい解説
イオン結晶
いおんけっしょう
ionic crystal
陽イオンと陰イオンとが静電引力によって凝集し、立体的に規則正しく配列してつくる結晶のこと。塩化ナトリウムNaCl、フッ化カルシウムCaF2のような単原子イオン結晶、硫酸アンモニウム(NH4)2SO4のような多原子イオンの結晶、ヘキサシアニド鉄(Ⅲ)酸カリウム(フェリシアン化カリウム、赤血塩)K3[Fe(CN)6]のような錯イオンの結晶などが知られている。これらにおける原子(イオン)の配列や原子間距離は、X線回折法、中性子線回折法、核磁気共鳴吸収分光法などによって測定される。
[岩本振武]
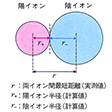
イオン半径
典型的なイオン結晶では、陽イオンと陰イオンの組合せを変えても、それぞれのイオンはほぼ一定の大きさであると考えられる。そこでイオンを剛体球とし、イオンの大きさをその半径で示した値が結晶イオン半径である。別に気体イオンを考えて、その半径を量子力学的に計算した値も得られるが、その値は結晶イオン半径とはかならずしも一致しない。イオン結晶で作用する静電引力は方向性がなく、あるイオンはなるべく数多くの反対符号イオンを周りに引き付け、しかもなるべく近く引き付けようとする。陰陽両イオンが接近すると核外電子間の反発力が大きくなり、引力と反発力が平衡に達したところでイオン結晶の構造が安定化する。このとき、両イオン間の最短距離が両イオンのイオン半径の和となる。イオン半径は、結晶構造や配位数(最短距離にある反対符号イオンの個数)によってやや異なるので、電子配置が同じになるイオンの組合せ(Na+とF-、K+とCl-など)で求めた最短距離をそれぞれのイオンの有効核電荷に逆配分比例で分割して求める。たとえばアルゴン(Ar)型電子配置をとるK+とCl-では、最短距離は314ピコメートル、有効核電荷はK+=7.4、Cl-=5.4となるので、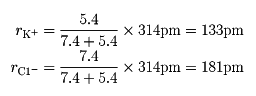
一般に同じ電子配置のイオンでは、多価の陰イオンほど大きい。そして多価の陽イオンほど小さいイオン半径が得られている。
周期表で同族となる同価イオンでは、原子番号が大きくなるほどイオン半径も大きくなる。
[岩本振武]
半径比則
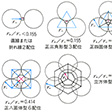
イオン結晶では、互いに半径の異なる陰陽両イオンが、なるべくすきまを少なくするように詰め込まれた構造をとろうとする。したがって、陽イオン半径r+と陰イオン半径r-の大小関係とイオン価はその構造に大きな影響を及ぼす。イオン半径の比r+/r-と配位数との関係を示す規則を半径比則という。一般にr+はr-より小さくなることが多いので、半径比の小さい状態から考えていくと、半径比が0.155未満では、陽イオンの周りには2個の陰イオンしか接近できない。0.155に達すると配位数は3となる。0.225に達すると、陰イオンは陽イオンを正四面体的に取り囲み、配位数は4となる。0.414に達すると、陽イオンは陰イオンによって正方形型に取り囲まれるとともに、上下からさらに2個の陰イオンが加わり、結局、正八面体構造となって配位数は6となる。0.732になると立方体8配位となり、1になると最密充填(じゅうてん)構造になる。立方体8配位のままであれば、半径比1の構造は体心立方構造と同じようなものとなる。
[岩本振武]
イオン結晶の構造
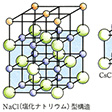
典型的イオン結晶は半径比則に従った配位構造をとる。半径比0.525となる塩化ナトリウムでは、塩化物イオンのつくる面心立方格子中の八面体型6配位の空隙(くうげき)にナトリウムイオンが入るが、そのナトリウムイオンも別に面心立方格子をつくっている。半径比が0.934となる塩化セシウムCsClでは立方体型8配位構造をとって、セシウムイオンは8個の塩化物イオンに囲まれる。この場合もセシウムイオンは別に立方体格子をつくっている。フッ化カルシウムでは半径比は0.728と計算されるが、実際にはCa2+は8個のF-によって立方体型8配位で囲まれる。Ca2+は面心立方格子をつくっており、見かけ上、その面心立方格子の四面体型4配位の空隙にF-が入っているような構造となる。それらのF-は単純立方格子をつくっている。典型的イオン結晶においても、いくらかは共有結合性がみられ、共有結合性の寄与が大きくなったイオン結晶では二次元的層状構造や一次元的鎖状構造をとることが多い。
[岩本振武]
イオン結晶の性質
イオン結晶は一般に絶縁体であるが、不純物や格子欠陥のために半導体となったり、高温度でイオン導電体になることがある。融解して液体になれば導電性を示す。イオン間距離が短く、イオン価の大きい結晶は一般に硬く、融点も高い。イオン結晶の融体は融解塩または溶融塩とよばれ、アルミニウムの電解精錬に用いられる氷晶石Na3[AlF6]の例のように、導電性溶媒や高温溶媒として利用される。不純物や格子欠陥のあるイオン結晶には、特徴のある色彩や、蛍光性あるいはリン光性を示すものがある。ルビーやサファイアは、本来無色の酸化アルミニウムの結晶(コランダム)に含まれる微量の不純物イオンによって赤あるいは青色を呈している。
[岩本振武]
『N・N・グリーンウッド著、佐藤経郎・田巻繁共訳『イオン結晶』(1974・培風館)』
改訂新版 世界大百科事典 「イオン結晶」の意味・わかりやすい解説
イオン結晶 (イオンけっしょう)
ionic crystal
正に帯電した陽イオンと負に帯電した陰イオンとがイオン結合によって構成する結晶で,電気的には中性である。典型的なイオン結晶としては岩塩NaClがよく知られているが,これの電子分布を調べてみると,自由な状態ではナトリウム原子Naに属していた電子の1個が塩素原子Clの近傍に移行し,結晶内ではそれぞれ希ガス型の電子配置をもつNa⁺とCl⁻とのイオンになっていることがわかる。多くの金属の塩がイオン結晶を作り,岩塩のほか,1価の陽イオンと陰イオンとが同数で格子を作るヨウ化セシウムCsI,2価陽イオンと1価陰イオンとよりなるフッ化カルシウムCaF2,2価イオンどうしで構成する酸化マグネシウムMgO,あるいは単原子イオンでないイオンからなる硫酸アンモニウム(NH4)2SO4などがある。一般にイオン結晶は一方のイオンが他種のイオンで囲まれるような構造をしており,2種のイオンはクーロン力によって電気的に引き合い,それぞれの電子雲が重なることによって起こる反発力とつり合ってイオン間の距離が決められる。この電子雲の広がりを球形とみなしその半径をイオン半径と呼ぶとき,イオン半径は各イオンそれぞれに特有な値となる。イオン結晶はその構成イオンのイオン半径の大小によって格子の型が決まる。一つのイオンに及ぼす結晶内の全イオンのクーロンポテンシャルの和を単位電荷,単位イオン間距離について表したマーデルンク定数は,多くの格子型について求められている。ほとんどのイオン結晶は一般に絶縁体であり,高温での電気伝導は主としてイオン伝導である。イオン結晶は化学的に純粋で良質な結晶が得やすく構造も簡単であることから,結晶の物理学的性質が詳細に調べられており,また,導入することのできるいろいろな格子欠陥の性質を研究するためにも利用されている。
→結晶
執筆者:三須 明
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「イオン結晶」の解説
イオン結晶
イオンケッショウ
ionic crystal
正負の電荷をもったイオンが立体的に規則正しく配列した結晶.結合力は,おもにイオン間の静電引力による.各イオンはできるだけ多くの異符号のイオンで囲まれようとする傾向があり,陽イオンのまわりの陰イオンの数を配位数という.配位数はイオン半径 r+/r- によって支配される.構成イオンは Na+,Ca2+,Cl- のような単原子イオンのみである場合も,その一部または全部がCO32-,NH4+のような錯基である場合もある.理想的イオン結晶はまれで,多くのイオン結晶の結合に共有結合性をもっている.理想的なイオン結晶としては,CsF,BaF2などがあげられる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「イオン結晶」の意味・わかりやすい解説
イオン結晶
イオンけっしょう
ionic crystal
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
最新 地学事典 「イオン結晶」の解説
イオンけっしょう
イオン結晶
ionic crystal
イオン結合による結晶。
執筆者:端山 好和
参照項目:イオン結合
出典 平凡社「最新 地学事典」最新 地学事典について 情報
百科事典マイペディア 「イオン結晶」の意味・わかりやすい解説
イオン結晶【イオンけっしょう】
→関連項目イオン結合
出典 株式会社平凡社百科事典マイペディアについて 情報
世界大百科事典(旧版)内のイオン結晶の言及
【固体】より
…イオン結合物質の典型的な例としては,食塩の主成分である塩化ナトリウムNaClをあげることができる。一般にイオン結合物質では,ナトリウムNaのように電子を放出して陽イオンとなりやすい原子と,塩素Clのように電子を受け入れて陰イオンになりやすい原子で構成され,陽イオンのまわりには陰イオンが,また陰イオンのまわりには陽イオンが配置して,両イオンの静電引力の結合で結晶(イオン結晶)がつくられる。他方,ダイヤモンド,ケイ素(シリコン),ゲルマニウムのIV族元素の固体では,同じ種類の原子が結合して物質がつくられる。…
※「イオン結晶」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...