精選版 日本国語大辞典 「硝酸ナトリウム」の意味・読み・例文・類語
しょうさん‐ナトリウムセウサン‥【硝酸ナトリウム】
日本大百科全書(ニッポニカ) 「硝酸ナトリウム」の意味・わかりやすい解説
硝酸ナトリウム
しょうさんなとりうむ
sodium nitrate
ナトリウムの硝酸塩。硝酸ソーダともいわれる。天然には南アメリカの太平洋沿岸地帯にチリ硝石として産出する。以前はこれを直接または精製のうえ使用していたが、今日では硝酸と水酸化ナトリウム(または炭酸ナトリウム)との中和反応によって製造されたものが主流となっている。無色の結晶。吸湿性があり、常温でも水によく溶けるが、温度の上昇とともに溶解度は著しく増大する。加熱すると酸素を放出して亜硝酸ナトリウムとなる。
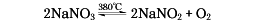
800℃以上になると急速に酸化物に分解する。
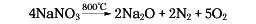
強力な酸化剤で、消防法危険物第1類に属し、有機物とともに強熱すれば爆発する。天然品は主として肥料に用いられる。合成品は、ガラスの消泡剤や融点降下剤、金属焼入れの熱処理剤、火薬の製造、食品添加剤(発色剤)、医薬などに使用される。
[鳥居泰男]
硝酸ナトリウム(データノート)
しょうさんなとりうむでーたのーと
硝酸ナトリウム
NaNO3
式量 85.0
融点 306.8℃
沸点 ―
比重 2.257
結晶系 三方
屈折率 (nD) 1.5874
溶解度 73g/100g(水0℃)
175.5g/100g(水100℃)
改訂新版 世界大百科事典 「硝酸ナトリウム」の意味・わかりやすい解説
硝酸ナトリウム (しょうさんナトリウム)
sodium nitrate
化学式NaNO3。天然にはチリ硝石として,チリをはじめとする南アメリカ太平洋岸の乾燥地帯から大量に産出する。無色三方晶系の結晶。硝酸ナトリウム型構造(方解石CaCO3型構造ともいう)。融点308℃。275℃以上で,結晶構造変化を伴わない転移がある。380℃以上で酸素を放って亜硝酸ナトリウムになり,750℃以上で過酸化ナトリウム,次いで酸化ナトリウムへと変化する。比重2.26。屈折率nD=1.5874。吸湿性がある。水100gへの溶解度は73g(0℃),91.8g(25℃),175.5g(100℃)。液体アンモニアに可溶,グリセリン,エチルアルコールに難溶。チリ硝石を水で抽出し,再結晶によって精製する。工業的には,硝酸に炭酸ナトリウムまたは水酸化ナトリウムを加えて中和し,熱水溶液を冷却して結晶を析出させ,高純度のものを得る方法が用いられる。肥料,硝酸カリウム(硝石)の製造,ガラスの消泡剤,うわぐすりの原料,染料中間体や医薬品製造,分析試薬などに用いられる。
執筆者:藤本 昌利
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「硝酸ナトリウム」の解説
硝酸ナトリウム
ショウサンナトリウム
sodium nitrate
NaNO3(85.00).天然にはチリ硝石として産出する.炭酸ナトリウムまたは水酸化ナトリウムに硝酸を作用させると得られる.無色の三方晶系結晶.密度2.26 g cm-3.融点308 ℃.380 ℃ で分解し,酸素を失って亜硝酸ナトリウムになる.吸湿性があり,水に易溶,エタノール,メタノールに可溶.硝酸,硝酸カリウムの製造,ガラス,窯業,融剤,医薬品,食品添加剤,肥料などに用いられる.[CAS 7631-99-4]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「硝酸ナトリウム」の意味・わかりやすい解説
硝酸ナトリウム
しょうさんナトリウム
sodium nitrate
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「硝酸ナトリウム」の意味・わかりやすい解説
硝酸ナトリウム【しょうさんナトリウム】
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「硝酸ナトリウム」の解説
硝酸ナトリウム
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

