精選版 日本国語大辞典 「炭酸ナトリウム」の意味・読み・例文・類語
たんさん‐ナトリウム【炭酸ナトリウム】
改訂新版 世界大百科事典 「炭酸ナトリウム」の意味・わかりやすい解説
炭酸ナトリウム (たんさんナトリウム)
sodium carbonate
化学式Na2CO3。俗に炭酸ソーダまたはソーダsodaと呼ばれる。無水和物はソーダ灰,10水和物Na2CO3・10H2Oは結晶ソーダまたは洗濯ソーダとも呼ばれる。化学工業上最も重要な製品の一つである。天然には,1水和物Na2CO3・H2Oがサーモナトライトthermonatrite(thermo-は熱の意。高温での晶出に由来する名)として産出。
性質
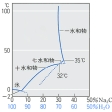
無水和物は無色の粉末。融点852℃。比重2.533。屈折率1.535。1000℃における解離圧19 torr(mmHg)。吸湿性がある。水100gへの溶解度7.1g(0℃),48.5g(104℃)。エチルアルコール,エーテルに不溶。10水和物(単斜晶系。比重1.45。屈折率1.425),7水和物(斜方晶系。比重1.51),1水和物(斜方晶系柱状または板状晶。比重1.56)があり,いずれも特有のアルカリ刺激性辛味を有する無色の結晶。水溶液からは32℃以下で10水和物,32~35℃で7水和物,35℃以上で1水和物が析出する(図1参照)。10水和物は空気中で風解して1水和物となりやすく,32℃で結晶水に溶ける。1水和物は潮解性があり,100℃以上で結晶水を失う。水100gへの溶解度は,10水和物21.5g(0℃),45.5g(30℃),1水和物48.9g(40℃)。10水和物はエチルアルコールに不溶。1水和物は25℃でグリセリン100gに14g溶け,エチルアルコール,エーテルに不溶。水溶液は加水分解して強いアルカリ性を示し,二酸化炭素を吸収して炭酸水素ナトリウムを生成する(CO2の吸収率は50℃で最大)。
Na2CO3+H2O⇄NaOH+NaHCO3
Na2CO3+CO2+H2O─→2NaHCO3
執筆者:藤本 昌利
工業的製造法
工業塩NaClの分解により製造する方法,苛性ソーダ(水酸化ナトリウム)の炭酸化,天然ソーダの精製,の3方式がある。日本ではおもに工業塩から製造する方法によるが,必要に応じ苛性ソーダの炭酸化も行われている。
(1)工業塩からの製造 乾式分解法と湿式分解法とがある。前者にルブラン・ソーダ法,後者にアンモニアソーダ法および塩安ソーダ法がある。アンモニアソーダ法はソルベー・ソーダ法(ソルベー法)とも呼ぶ。塩安ソーダ法はアンモニアソーダ法の合理的改良法である。
(a)ルブラン・ソーダ法(ルブラン法)Leblanc soda process 1778年フランスのN.ルブランの発明が,1823年にイギリスで工業化され,ソルベー法の興隆までの約100年間は本法の全盛時代であったが,現在は工業的には消滅した。次の反応群で構成されるプロセスである。
NaCl+H2SO4─→Na2SO4+HCl ……(1)
Na2SO4+C─→Na2S+CO2 ……(2)
Na2S+CaCO3─→Na2CO3+CaS ……(3)
CaS+H2O+CO2─→CaCO3+H2S ……(4)
H2S+O2─→S+H2O ……(5)
(1)(2)が費用のかかる高温乾式処理であり,製品Na2CO3の純度もアンモニアソーダ法より劣った(40~45%)ので,後発の新法に対抗できなかった。(1)の応用によりKClからK2SO4を製造する方式は現在も行われている。(5)のSからH2SO4をつくれば,循環工程になる。
(b)アンモニアソーダ法ammonia soda process 〈ア法〉と略称する。1860年代にE.ソルベーが発明,工業化した。関連反応は次の(6)~(11)で,(7)の溶液中の複分解反応がア法の主体である。
NH3+CO2+H2O─→NH4HCO3 ……(6)
NaCl+NH4HCO3⇄NaHCO3+NH4Cl ……(7)
NaHCO3─→Na2CO3+CO2+H2O ……(8)
NH4Cl+Ca(OH)2─→CaCl2+NH3+H2O ……(9)
CaCO3─→CaO+CO2 ……(10)
CaO+H2O─→Ca(OH)2 ……(11)
まず工業塩を水に溶かし濃厚かん(鹹)水とし,アンモニアガスを吹き込みアンモニアかん水(安かん水)をつくる。次に炭酸化塔で二酸化炭素を吸収させる。(6)で生成する炭酸水素アンモニウムにより液中でNaClが分解される。(7)で生成した炭酸水素ナトリウム(重曹)の溶解度が系中最小なので水冷することにより沈殿となる。これをろ(濾)別し,焙焼すると(8)の炭酸ナトリウムとなる。具体的には粗製重曹を焙焼して軽質ソーダ灰を得,これを加水するとNa2CO3・H2Oとなるので,さらに乾燥脱水させて重質ソーダ灰とする。(7)の母液にCa(OH)2(石灰乳)を加え加熱蒸留し,NH3を回収循環させる。(8)と(10)との双方でCO2が生じるので,これを(6)に循環させる。全反応を総合すると,
NaCl+CaCO3─→Na2CO3+CaCl2 ……(12)
の複分解がア法の主旨であることがわかるが,直接には進行しえないため(6)~(11)に分割して目的を達する。ア法の工程中における(7)の反応の4成分の組成変化模式図を平面に投影して描くと図2のようになる。
(c)塩安ソーダ法 (7)は化学平衡になるため,工業的NaClの利用率は70~73%が限界値である。すなわち未反応のNaClは廃液中に残る。この点を改良する目的で,NaHCO3分離母液中からNH4Clを副製品として析出分離させるというプロセスが,すでに1880年代にまず提案された。シュライブ法(ないし新シュライブ法)または深冷法(冷却法)と呼ぶ一連の方式がそれである。NaHCO3母液に精製塩NaClを飽和させ,液を0~5℃程度に冷却してNH4Clを析出させる方法で,深冷法の名称はこれに由来する。この方式ではNH4ClにNaHCO3が共沈する欠点があった。これを改め技術的完成度を高めたものが塩安ソーダ法で,日本独自の開発になり,1950年ころから工業化された。原料塩のほとんど全部を輸入に頼る日本ではNaClの完全利用を必須とする。この方法は図3に示すようなサイクル工程からなる。原料系としてNaCl,NH3,CO2,NH3が順次添加され,生成系としてNaHCO3,NH4Clが交互に析出する。その結果Naの利用率は理論上100%になる。シュライブ法との差異は,NaHCO3分離後一度NH3を吸収させてからNaClを加えるよう改めた点にある。本来のア法での石灰焼成炉,アンモニア蒸留塔が不要になるが,一方アンモニア合成設備を必要とする。CO2はNH3合成時の副生物として得られるので,それを利用する。本法は無機化学工業における完全循環工程の実施例として意義が大きい。
(d)アンモニアソーダ法の他の変法 塩安ソーダ法確立以前にもいくつかのア法変法が発表された。シュライブ法もむろんその一つであり,ほかにも次の3法がある。ツァーン法(中間塩法)は易溶性の他種ナトリウム塩NaX(X=SO4,NO3など)を共存させた溶液に固体NH4HCO3を添加し,NaHCO3を析出させる。液体アンモニア法(液安法)はNaClが液体NH3に対し高溶解性をもつことを利用し,カルバミン酸ナトリウムをつくり,これを水蒸気分解してNaHCO3を得る。
NaCl+NH3+CO2─→NaCO2NH2+NH4Cl
NaCO2NH2+H2O─→NaHCO3+NH3
加圧下ア法はCO2圧力数十気圧まで加圧して行う方法であるが,ア法全体として反応率がそれほど有利にはならない。
(2)苛性ソーダの炭酸化 工業塩電解で苛性ソーダと塩素とを同時生産する際,需要バランスの関係で,苛性ソーダが供給過剰になった場合に,その一部を炭酸化して炭酸ナトリウムに転換する。すなわち苛性ソーダ溶液(48%)に炭酸ガスを反応させて炭酸ナトリウムを液中につくらせる。次に濃縮してNa2CO3・H2OまたはNa2CO3を析出分離させる。1水和物の場合焙焼してNa2CO3とする。
NaOH+CO2─→Na2CO3・H2O ……(13)
(3)天然ソーダの精製 大量のソーダ資源を利用して工業的に実施しているのは,アメリカ,ケニアである。アメリカではトロナ鉱石を採掘し(ワイオミング州南西部に多い),焙焼,水溶解,再結晶などの各工程を経て炭酸ナトリウムを得る。
Na2CO3・NaHCO3・2H2O─→Na2CO3・H2O+NaOH+CO2+H2O ……(14)
用途
板ガラスをはじめ各種ガラス製品の主原料の一つ,鉄鋼の脱硫用,乾式リン肥製造副原料,苛性ソーダ・重曹・水ガラス・縮合リン酸ソーダなどの工業薬品系各種ナトリウム塩の原料,調味料(アミノ酸など)の原料,セッケンの製造ならびに粉セッケンその他の洗剤の配合用,染料・香料・医薬・農薬等のアルカリ源として用いられ,また分析および合成用試薬ともされる。
→水酸化ナトリウム →炭酸カリウム
執筆者:金澤 孝文
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「炭酸ナトリウム」の意味・わかりやすい解説
炭酸ナトリウム
たんさんなとりうむ
sodium carbonate
炭酸のナトリウム塩。俗に炭酸ソーダまたは単にソーダといわれる。無水和物にはソーダ灰(無水炭酸ナトリウム)、十水和物には洗濯ソーダ(結晶ソーダ)の名がある。自然界には一水和物(サーモナトライト)、十水和物(ナトロン)として存在する。炭酸ナトリウムを多く含んだ塩湖すなわちソーダ湖の周辺や湖底にはNa2CO3・NaHCO3・2H2Oの組成の結晶となって堆積(たいせき)しておりトロナとよばれる。このような組成の天然ソーダはアメリカ、アフリカ、エジプト、中国などに多量に産出する。古代エジプトでガラスやせっけんなどの製造に用いられた世界最初のソーダである。炭酸ナトリウムは海藻を焼いた灰の中にも含まれ、昔はこれから抽出されていた。
[鳥居泰男]
製法
工業的にはアンモニアソーダ法(ソルベー法)、ルブラン法、電解ソーダ法の三つの方法があるが、現在日本ではアンモニアソーダ法以外はほとんど行われていない。この方法では食塩の飽和溶液にアンモニアを吸収させたのち、二酸化炭素を通ずる。析出してきた炭酸水素ナトリウムを焼いて炭酸ナトリウムとする。ナトリウムの利用率を高めるため、日本ではこの方法の変形として塩安ソーダ法が開発されている。
なお、近年天然ソーダの採掘が大規模に行われるようになり、アメリカなどでは生産量の80%以上がこの方法によっている。
[鳥居泰男]
性質
無水和物は白色吸湿性の粉末で、水によく溶けるがアルコールには溶けにくい。水溶液から結晶が析出する場合、32℃以下では十水和物、32~35℃では七水和物、35℃以上では一水和物となる。一水和物は白色潮解性の結晶。十水和物は風解性の結晶で、空気中で結晶水を失って一水和物となる。32℃で結晶水の中に溶ける。水溶液は加水分解して強いアルカリ性を示す。
Na2CO3+H2O NaHCO3+NaOH
NaHCO3+NaOH
塩酸や硫酸などの強酸を加えると二酸化炭素を発生する。逆に、二酸化炭素を吸収させると炭酸水素ナトリウムが沈殿してくる。
[鳥居泰男]
用途
炭酸ナトリウムはアルカリとして、またナトリウム源として広く利用され化学工業上もっとも重要なものの一つである。ガラスの原料となるほか、せっけん、紙パルプ、食品、化学薬品の製造に用いられる。また、洗濯用洗剤、医薬品としての用途もある。
[鳥居泰男]
炭酸ナトリウム(データノート1)
たんさんなとりうむでーたのーと
炭酸ナトリウム一水和物
Na2CO3・H2O
式量 124.0
融点 ―
沸点 ―
比重 1.55
結晶系 斜方
屈折率 (n) 1.506~1.509
溶解度 48.9g/100g(水40℃)
炭酸ナトリウム(データノート2)
たんさんなとりうむでーたのーと
炭酸ナトリウム
Na2CO3
式量 106.0
融点 851℃
沸点 ―
比重 2.533
屈折率 (n) 1.535
溶解度 7.1g/100g(水0℃)
解離圧 19mmHg/1000℃
化学辞典 第2版 「炭酸ナトリウム」の解説
炭酸ナトリウム
タンサンナトリウム
sodium carbonate
Na2CO3(105.99).炭酸ソーダまたは単にソーダともいう.無水物はソーダ灰,十水和物は洗濯ソーダともよばれる.サーモナトライトとして一水和物が天然に産出する.工業的にはアンモニアソーダ法(ソルベー法)でつくる.炭酸水素ナトリウムを加熱分解すると無水物が得られる.無水物は白色の粉末.融点851 ℃.密度2.53 g cm-3.水100 g に対する溶解度は7.1 g(0 ℃),48.5 g(104 ℃).エタノール,エーテルに不溶.水溶液から晶出させると十水和物( < 32.08 ℃),七水和物(32.08~35.27 ℃),一水和物( > 35.27 ℃)が析出する.十水和物は単斜晶系結晶.密度1.44 g cm-3.空気中で風解して一水和物となる.一水和物は白色の斜方晶系結晶.密度2.25 g cm-3.潮解性で,100 ℃ で無水物となる.水溶液は加水分解して弱アルカリ性を示す.また,二酸化炭素を吸収して炭酸水素ナトリウムを生じる.化学工業上もっとも重要な化合物の一つである.せっけん,ガラス,水酸化ナトリウム,炭酸水素ナトリウムの原料,製紙,染料工業,洗濯用などに用いられ,分析試薬,食品添加物,医薬品としても用いられる.[CAS 497-19-8:Na2CO3][CAS 6132-02-1:Na2CO3・10H2O]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「炭酸ナトリウム」の意味・わかりやすい解説
炭酸ナトリウム【たんさんナトリウム】
→関連項目ソーダ灰|脱硫|炭酸水素ナトリウム|発泡剤
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「炭酸ナトリウム」の意味・わかりやすい解説
炭酸ナトリウム
たんさんナトリウム
sodium carbonate
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「炭酸ナトリウム」の解説
炭酸ナトリウム
世界大百科事典(旧版)内の炭酸ナトリウムの言及
【ソーダ】より
…炭酸ナトリウムNa2CO3の俗称。曹達と書くこともある。…
※「炭酸ナトリウム」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...