ナトリウム(その他表記)Natrium[ドイツ]
精選版 日本国語大辞典 「ナトリウム」の意味・読み・例文・類語
ナトリウム
改訂新版 世界大百科事典 「ナトリウム」の意味・わかりやすい解説
ナトリウム
Natrium[ドイツ]
sodium
周期表第ⅠA族に属するアルカリ金属元素の一つ。Natriumという名称は,天然ソーダやアルカリ塩を意味するギリシア語のnitronに由来し,sodiumは炭酸ナトリウムが古くからソーダsodaと呼ばれていたことに基づいて命名された。最近では英語でもときにnatriumという場合がある。
ナトリウム化合物とカリウム化合物が区別されたのは16世紀ころで,1758年A.S.マルクグラーフはナトリウムの炎色(黄色)とカリウムの炎色(紫色)の相違を指摘している。1807年イギリスのH.デービーが水酸化ナトリウムの溶融塩電解により初めて単体(金属)を単離した。90年にはH.Y.カストナーが溶融塩電解法によって金属ナトリウムの工業製造に成功した。地殻中にはカルシウムに次いで多量に存在する。反応性が大きいため遊離のまま産することはなく,ソウ長石,斜長石,カスミ石(ネフェリン),氷晶石などとして地殻中に広く分布している。海水中に塩化ナトリウムとして大量に溶存し(約3%),岩塩として巨大な鉱床をつくり,ともに重要な工業資源となっている。また硝酸塩(チリ硝石),硫酸塩(ボウ硝),ホウ酸(ホウ砂),炭酸塩(天然ソーダ)などの鉱物として各地に産する。ナトリウムイオンは動物の体内での生理に重要な役割をもっている。
性質
銀白色の軟らかい金属。ナイフで切ったり,小孔から押し出して針金に引いたりすることができる。蒸気は紫色を帯びているが,高温では黄色。結晶は体心立方格子(格子定数a=4.2820Å(20℃))。モース硬度0.4。表面張力293.6dyn/cm(97.7℃)。比熱0.288(20℃),0.3369cal/K・g(150℃,液体)。熱伝導率0.316cal/cm・s・deg(18℃)。融解熱27.5cal/g。気化熱1100cal/g。臨界温度2000℃。臨界圧343気圧。電気の良導体で,比抵抗4.6×10⁻6(18℃),9.898×10⁻6Ωcm(100℃,液体)。常磁性,磁化率0.68×10⁻6emu。炎色反応は黄色(スペクトル線はD線5889.97および5895.93Åの二重線)で,きわめて鋭敏,10⁻6mg程度のNaが検出できる。電気的陽性がきわめて強い。化学的性質はカリウムに似ているが,カリウムほど激しくはない。空気中で酸化されて速やかに光沢を失い,湿気や二酸化炭素のために炭酸ナトリウム皮膜でおおわれる。常温で自然発火することはないが,融点以上に熱すれば黄色の炎を上げて燃え,過酸化ナトリウムNa2O2になる。水とは-98℃でも反応して水素を発生する。常温では反応熱のため融解し,水酸化ナトリウムとなって溶解する。水温が40℃を超えると水素が自然発火するので危険である。エチルアルコールとは水素を発生して反応し,ナトリウムエトキシドNaOC2H5を生ずるが,-48℃以下では作用しない。ジエチルエーテルとは反応しない。ベンゼン,ガソリン,灯油に不溶。水素中で熱すると水素化物NaHとなる。水銀と激しく反応してナトリウムアマルガムをつくる。臭素,ヨウ素とは激しく反応するが,乾いた塩素,フッ素とは常温で反応しない。フッ化水素とは常温でほとんど反応しない。乾燥した塩化水素とは融点以上で反応する。液体塩化水素中には気体を発生しないで溶けるが,塩酸とは爆発的に反応する。硫黄,セレンとは激しく反応する。硫化水素とは常温で反応し,熱すればその中で燃える。アンモニアと常温で徐々に反応し,300~350℃でナトリウムアミドNaNH2をつくる。液体アンモニアに溶け,青色 で生じたアンモニア和電子
で生じたアンモニア和電子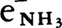 の光吸収による)溶液をつくる。窒素とは反応せず,リン,ヒ素,アンチモンとは直接化合する。濃硝酸と接触すると自然発火する。ホウ素,ケイ素,炭素とは加熱により直接反応し,アセチレンと反応すると炭化ナトリウムNa2C2をつくる。多くの金属の酸化物や塩を還元して金属を遊離する。二酸化炭素と赤熱すれば炭素,酸化ナトリウム,炭酸ナトリウムを生ずる。高温で石英,ガラス,磁器を侵し,水酸化ナトリウム中に融解して溶ける。
の光吸収による)溶液をつくる。窒素とは反応せず,リン,ヒ素,アンチモンとは直接化合する。濃硝酸と接触すると自然発火する。ホウ素,ケイ素,炭素とは加熱により直接反応し,アセチレンと反応すると炭化ナトリウムNa2C2をつくる。多くの金属の酸化物や塩を還元して金属を遊離する。二酸化炭素と赤熱すれば炭素,酸化ナトリウム,炭酸ナトリウムを生ずる。高温で石英,ガラス,磁器を侵し,水酸化ナトリウム中に融解して溶ける。
製法
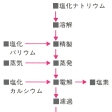
工業的には古くは水酸化ナトリウムの溶融塩電解(カストナーCastner法)が行われたが,現在ではほとんど塩化ナトリウムと塩化カルシウムの混合物の溶融電解(ダウンスDowns法)によってつくられている。高純度のものはアジ化ナトリウムNaN3の熱分解によって実験室的に製する。
用途
合成化学工業における重要な試薬で,高級アルコール,染料,アルコラート,医薬,香料などの製造に,ナトリウムアマルガムは還元剤に用いられる。熱中性子吸収断面積が小さく,低融点,熱良導性のため,単独またはカリウムとの液体合金Nak(ナク)(Na:Kは重量比で22:78,融点-11℃,沸点784℃)として原子炉冷却材に使用。強い還元力のため,ケイ素,チタン,ジルコニウム,ホウ素などの製錬に利用され,そのほか陰イオン重合触媒,ナトリウムランプ,光電管の製造に,また液体合金Nakは還元剤,高温用温度計にも用いられる。
取扱い上の注意
石油などの炭化水素系溶媒中に沈め,空気および水との接触を断って密封保存する。アルコール,クロロホルムなどの含ハロゲン溶媒との接触も危険である。高温時および大量の貯蔵時には,水との不用意な接触による反応熱で火災を起こすおそれがあるため,とくに厳重に保管しなければならない。
→カリウム
執筆者:藤本 昌利
原子炉材料
液体金属冷却高速増殖炉の冷却材として利用される。日本での使用例は〈常陽〉〈もんじゅ〉である。ナトリウムは室温では固体であるが,融点97.8℃から沸点882℃の広い温度範囲で加圧せずに液体の冷却材として使用でき,熱伝導度も高く,すぐれた冷却材である。冷却系統の構成材料を侵す可能性があるが,高純度とし,とくに酸素の濃度を下げるとステンレス鋼などとの両立性がよい。また,単原子なので放射線分解の心配もなく,誘導放射能もある程度時間をかけて減衰を待てばとくに問題にならない。また,化学的に活性であるので,万一,冷却系から漏れ出したときのために適切な配慮が必要である。
執筆者:大久保 忠恒
生体とナトリウム
ほぼすべての生物に存在する重要な生体構成元素で,通常陽イオンNa⁺として存在する。脊椎動物の血漿中では1ml当り30~50mgも含まれる。動物の血漿や細胞外液には多量に含まれるが,細胞内にはその1/10程度しか含まれない。比較的高い塩分濃度の環境に生育する植物の生長を制御する働きがあるといわれている。動物細胞では,細胞外液のpH,浸透圧,容積の調節などに関与し,Na⁺の排出は,副腎皮質ホルモンのミネラルコルチコイドによって制御されている。また,神経の興奮伝達,筋収縮,心臓拍動,繊毛運動などの興奮性の細胞現象にも関与する。Na⁺,K⁺-ATPアーゼによるイオンの能動輸送の結果,一時的にイオンの濃度こう配に変化が起き,これが原因で種々の生理現象が起きる。たとえば,神経細胞が興奮したときには,細胞膜の透過性が一時的に高くなり,細胞内へNa⁺が流入し,K⁺が外部へ流出する。このため膜内の静止電位が一時的に低下する。
執筆者:柳田 充弘
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「ナトリウム」の意味・わかりやすい解説
ナトリウム
なとりうむ
sodium 英語
Natrium ドイツ語
周期表第1族に属し、アルカリ金属元素の一つ。ナトリウム、ソジウムの名称は鉱物性アルカリを意味するラテン語のnitrum, solidaに由来し、炭酸ナトリウム(炭酸ソーダ)の古名natron sodaに基づくといわれている。
[鳥居泰男]
歴史
ナトリウムは、化合物の形では人類文明の黎明(れいめい)期からすでに利用されていた。5000年も前にエジプト人はソーダ湖から炭酸ナトリウム(ソーダ)を採取し、砂や貝殻と混ぜてガラスをつくっていた。この物質は古くから清浄剤や洗剤としても用いられており、また塩化ナトリウムは食塩の名で食品の保存や調味料として使われてきた。しかしナトリウムの化合物が同族のカリウム化合物と明白に区別されるようになったのは、1758年のドイツのマルクグラーフの炎色反応の実験以後である(ナトリウム化合物は黄色、カリウム化合物は淡紫色の炎色反応を示す)。1807年にイギリスのH・デービーは、水酸化ナトリウムを白金るつぼ中で加熱融解し、電気分解することによって金属ナトリウムを単離し、ソジウムと命名した。1890年にはアメリカの化学技術者カストナーHamilton Young Kastner(1858―1899)によって工業的製造の方法が開かれた。
[鳥居泰男]
存在
ナトリウムは他のアルカリ金属元素と同様に反応性に富んでいるため、自然界で単体金属の状態をとることはできない。つねに1価の陽イオンとして化合物をつくり、地球上に広く分布している。海水中に、塩化ナトリウムに換算して平均2~3%の濃度で存在しているが、特別の場合として、ヨルダンとイスラエルにまたがる死海では20%もの濃度に達している。塩化ナトリウムはまた岩塩として巨大な鉱床をつくっている。炭酸塩(天然ソーダ)、硝酸塩(チリ硝石)、硫酸塩(ボウ硝)、ホウ酸塩(ホウ砂)なども鉱物として世界各地に産出する。また、不溶性のアルミノケイ酸塩、たとえば方沸石NaAlSi2O6・H2Oやソーダ長石NaAlSi3O8などにも含まれている。ナトリウムはまた動物体内に比較的多量に含まれ、組織液の浸透圧の維持や水素イオン濃度指数(pH)を一定に保つなどの重要な生理的役割を果たしている。
[鳥居泰男]
製法
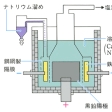
工業的には融解塩を電気分解する方法によって製造されるが、原料として水酸化ナトリウムを用いるカストナー法と、塩化ナトリウムを用いるダウンズ法とがある。カストナー法では、鉄またはニッケルを陰極とし、黒鉛を陽極として320℃(水酸化ナトリウムの融点は318.4℃)付近で電解を行う。陰極では
2Na++2e-―→2Na
の反応がおこって金属ナトリウムが遊離し、陽極では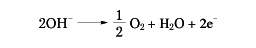
の反応によって酸素が発生する。ダウンズ法では、原料の塩化ナトリウムの融点(800.4℃)を下げるために塩化カリウムや塩化カルシウムを加える。こうすると600℃付近で電解が可能となる。この方法では陽極で
2Cl-―→Cl2+2e-
の反応がおこり、塩素が副産物として得られる。ダウンズ法では、塩化ナトリウムを水酸化ナトリウムに変えずに直接原料とすることができるうえ、電流効率も高く、塩素ガスが副生するなど多くの利点があるので、今日ではダウンズ法により多く製造されている。金属ナトリウムは減圧蒸留によって精製することができる。
[鳥居泰男]
性質
銀白色の軟らかい金属で、常温では体心立方構造をとっている。ナイフで切ったり、小孔から押し出して容易に針金状にすることができる。新しい面は金属光沢を呈するが、空気に触れるとただちに酸化されて光沢を失う。融点以上に熱すると炎をあげて燃える。ハロゲン、酸素などと激しく反応し、水素とも化合物をつくる。また水とも激しく反応して水素を発生し、反応熱のためにナトリウム自体は球状となって水面を走り回り、水酸化ナトリウムを生ずる。さらに発生した水素が空気と混合して爆発をおこす。したがって、保存するときは石油中に蓄えておく必要がある。ナトリウム塩は一般に水によく溶ける。
[鳥居泰男]
用途
各種金属の製錬において還元剤となるほか、アマルガムとして各種の還元、さらに合金、触媒などとしても用いられる。また、融点が低く、熱中性子吸収断面積が小さいのを利用し、単独またはカリウムとの合金(Na‐K系合金、ナクという)として原子炉の冷却剤に用いられる。
[鳥居泰男]
人体とナトリウム
人体に約0.15%含まれ、無機質の元素のなかではカルシウム、リン、カリウム、塩素、マグネシウムなどと同様に比較的多く存在するものである。体内では細胞外液におもに存在し、細胞内液には少ない。ナトリウムは細胞外液の分量の維持、浸透圧の調整、酸・塩基平衡の維持などの重要な働きをしている。また、神経や筋肉の刺激を伝達する機能に必要な成分である。ナトリウムが細胞外液の調節をしているのに対し、カリウムは細胞内液の各種の調節に関係している。その境界である細胞膜では膜の内外でナトリウムとカリウムをそれぞれ適度な濃度に保っている。この仕組みはナトリウムポンプと考えられている。ナトリウムはこのように一定量存在することがたいせつであるが、長期間食事から塩として摂取する量が多い場合、ナトリウム過剰の害が問題となっている。とくに、高血圧症や胃がんの原因となる。そのため厚生労働省は、「日本人の食事摂取基準」で、12歳以上は食塩としての摂取目標量を1日に10グラム未満と設定している。なお、WHO(世界保健機関)では1日6グラム以下が適当としている。
[河野友美・山口米子]
『糸川嘉則編『ミネラルの事典』(2003・朝倉書店)』▽『第一出版編集部編『厚生労働省策定 日本人の食事摂取基準 2005年版』(2005・第一出版)』
ナトリウム(データノート)
なとりうむでーたのーと
ナトリウム
元素記号 Na
原子番号 11
原子量 22.98977
融点 97.81℃
沸点 882.9℃
比重 0.971(測定温度20℃)
液体 0.93(測定温度98℃)
結晶系 立方
臨界温度 2000℃
臨界圧 343気圧
元素存在度 宇宙 (Si 106個当りの原子数)
6.32×104(第14位)
地殻 2.36%(第6位)
海水 10.77×106μg/dm3
化学辞典 第2版 「ナトリウム」の解説
ナトリウム
ナトリウム
sodium
Na.原子番号11の元素.電子配置1s22s22p63s1の周期表1族元素.原子量22.99.安定同位体は 23Na だけであるが,ほかに6種類の放射性同位体が知られている.1807年H. Davy(デイビー)が水酸化ナトリウムの融解電解ではじめて金属を遊離した.同年,Davyはsodaとして知られていた天然炭酸ナトリウムから元素名sodiumを提案した.一方,ドイツ語圏では1797年にM.H. Klaprothがsodaのかわりに古くから使われていたNatronとよぶことを薦め,1809年にドイツのL.W. Gilbertが元素名にNatroniumを提案,1813年J. Berzelius(ベルセリウス)が短縮形Natriumを使いはじめた.今日でも元素名は,英・仏語圏ではsodium,ドイツ語圏ではNatriumで,日本語の元素名はドイツ語名を採用している.しかし,宇田川榕菴は天保8年(1837年)出版の「舎密開宗」で,曹冑母(ソウチウム)ソーダ,メタールと記載している.
天然には,チリ硝石(硝酸塩),ボウ硝(硫酸塩),ホウ砂(ホウ酸塩),天然ソーダ(炭酸塩)などの鉱物として広く分布している.地殻中の存在度23000 ppm.海水中には塩化ナトリウムとして約3% 含まれている.ナトリウムの水酸化物または塩化物の融解電解により得られる.真空蒸留により精製する.銀白色の軟らかい金属.等軸晶系.体心立方格子構造.格子定数a = 0.428 nm(20 ℃).融点97.8 ℃,沸点883 ℃.密度0.971 g cm-3(20 ℃).融解熱2.63 kJ mol-1.イオン化電位5.138 eV.炎色反応は黄色.空気中で酸化されてただちに光沢を失う.水とはげしく反応して水素を発生し,水酸化ナトリウムとなる.このとき,生成する反応熱のため水素が発火することもある.ハロゲン,酸素,ホウ素,炭素,ケイ素,硫黄族の元素とはげしく反応し,リン,ヒ素,水素とも化合する.アンモニアと反応しナトリウムアミドを生じる.高温では二酸化炭素,ケイ酸塩などとも反応し,ガラス,磁器を侵す.酸とは爆発的に反応する.塩においては酸化数1のイオンとして存在し,塩は一般に無色で,水に易溶で結晶水をもつものが多く,潮解性のものも少なくない.
原子炉の冷却剤,ナトリウム化合物の製造,有機合成の還元剤,チタン・ジルコニウムなどの金属の製造,陰イオン重合触媒などに用いられる.[CAS 7440-23-5]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「ナトリウム」の意味・わかりやすい解説
ナトリウム
→関連項目増殖炉|ナトリウムランプ|ブナ
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「ナトリウム」の意味・わかりやすい解説
ナトリウム
sodium
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
漢方薬・生薬・栄養成分がわかる事典 「ナトリウム」の解説
ナトリウム【Natrium】
食の医学館 「ナトリウム」の解説
ナトリウム
栄養・生化学辞典 「ナトリウム」の解説
ナトリウム
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...