日本大百科全書(ニッポニカ) 「緩衝溶液」の意味・わかりやすい解説
緩衝溶液
かんしょうようえき
buffer solution
溶液に酸または塩基を加えた場合におこる水素イオン濃度の変化を小さくする作用を緩衝作用といい、この緩衝作用をもつ溶液を緩衝溶液あるいは緩衝液という。
1909年デンマークの生化学者セーレンセンSøren Peter Lauritz Sørensen(1868―1939)が、塩酸、水酸化ナトリウム、グリシンのほか、リン酸、クエン酸、ホウ酸などとその塩の混合溶液が緩衝作用をもつことを初めてみいだし、緩衝溶液をつくった。一般に弱酸とその塩、あるいは弱塩基とその塩の混合溶液をいい、溶液の水素イオン指数pHを一定に保つ必要がある場合に用いる。またある種の緩衝溶液はpH測定の際のpH標準溶液として用いられる。
酢酸CH3COOHおよび酢酸ナトリウムCH3COONaの混合溶液で生じる緩衝溶液を例にとる。酢酸については式(1)の解離平衡が成り立つ。
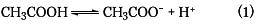
酢酸は弱酸なので電離度が小さく、酢酸イオンCH3COO-の濃度は酢酸に比べて非常に小さい。一方、酢酸ナトリウムは強電解質なので式(2)のように完全解離する。
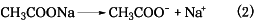
したがって、この二つの溶液を混合すると、溶液中の酢酸イオン濃度は、ほぼ酢酸ナトリウムから生じたもので占められる。この溶液に塩酸のような酸を加えると、溶液中に生じている大量の酢酸イオンと反応して、加えられた塩酸の水素イオンH+は酢酸を生成し、式(1)の反応は右から左へ進むので、溶液中の水素イオン濃度はほとんど変化せず、pHは一定に保たれる。また、水酸化ナトリウムのような塩基を加えると、溶液中のH+と塩基のOH-とが中和してH2Oを生成するが、式(1)の反応が左から右に進み、H+の消費を補うので、溶液中の水素イオン濃度はほぼ一定に保たれ、pHはほとんど変化しないことになる。このように緩衝溶液は酸や塩基を加えても、溶液のpHをあまり変化させない能力をもち、このような能力を緩衝能という。優れた緩衝溶液は高い緩衝能をもつということができ、また組成を変化させて広いpH領域をカバーできるものであるということができる。
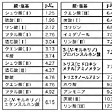
緩衝液を調製するには目的のpH領域を緩衝する試薬を選ばなければならない。酸のpKa(Kaは酸解離定数。pKaはpHと同じくKaの逆数の対数を表す)を中心にして前後0.5pH単位のpH範囲で十分な緩衝能があるので、酸のpKa値から目的の緩衝液を容易に選ぶことができる。緩衝液を調製するのに用いられる酸塩基試薬とpKa値をに示す。
アンモニアNH3は普通、塩基解離定数Kbが定義されている。すなわち
NH4OH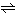 NH4++OH-
NH4++OH-
の平衡が成り立ち、
Kb=[NH4+][OH-]/[NH4OH]
である。一方、共役酸NH4+は次のように加水解離する。
NH4++H2O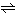 NH4OH+H+
NH4OH+H+
この加水分解定数をKhと表すと、
Kh=[NH4OH][H+]/[NH4+]
となる。ただし水の濃度は平衡定数に含めた。すなわち平衡定数をKとすると
Kh=K[H2O]
である。Khの式の分母子に[OH-]を掛け、水のイオン積が
Kw=[H+][OH-]
であることを考慮すると、上式はKh=Kw/Kbとなる。酸塩基理論ではKa・Kb=Kwであるから、ここで定義した加水分解定数は塩基NH3の共役酸であるNH4+イオンの酸解離定数である。このようにして塩基もその共役酸の酸解離定数が与えられれば塩基解離定数が求められることになり、酸解離定数で統一して表すことがある。ただし、25℃、イオン強度0mol・dm-3であることに注意すべきである。
pHの標準となる溶液は緩衝溶液である。現在もっともよく使われる酸性、中性、アルカリ性の標準溶液をに示す。
pHの標準については、定義はpH=-loga(H3O+)であるが、その値を厳密に測定することができないので、現在では次の方法で測定可能なpHを定義している。pH(s)とpH(x)の二つの溶液のそれぞれについて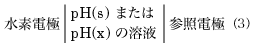
の電池をつくり、その起電力の値がそれぞれE(s)とE(x)であるとき、次式でΔpHを定義する。
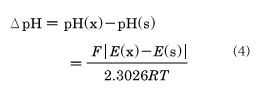
ここで、Rは気体定数、Tは絶対温度、Fはファラデー定数である。この定義は「水素電極と甘汞(かんこう)(塩化水銀(Ⅰ))電極などの参照電極とを用いて(3)式の電池の起電力を二つの溶液について測定したとき、その起電力の差がF/2.3026RTに等しければ、その溶液間のpHの差は1.000である」ということになる。つまり、(4)式の定義は単にpHの差を定義したにすぎないから、pHの原点を決める必要がある。現在、この原点として、「0.05mol・kg-1(重量モル濃度)のフタル酸水素カリウム水溶液の15℃におけるpHを4.000とする」というのが世界的に採用されているが、日本のJIS(日本工業規格)ではこの原点の溶液濃度を0.05M(=mol・l-1。容量モル濃度)としている。ただし、その両者の差はせいぜい0.0009pH程度で、実用的には問題ない。
なお、人名の付いた緩衝液が知られている。に代表的な緩衝液の組成と緩衝pH領域を示す。
[成澤芳男]
『ダグラス・ダルゼル・ペリン、ボイド・デンプシ著、辻啓一訳『緩衝液の選択と応用 水素イオン・金属イオン』(1981・講談社)』▽『日本分析化学会編『分析化学便覧』改訂3版(1981・丸善)』▽『日本化学会編『化学便覧 基礎編』改訂4版(1993・丸善)』▽『足立吟也・石井康敬・吉田郷弘編『物理化学実験のてびき』(1993・化学同人)』▽『伊豆津公佑・堀智孝・杉山雅人・藤永薫著、藤永太一郎編著『基礎分析化学』改訂新版(1994・朝倉書店)』▽『日本分析化学会編『定量分析』(1994・朝倉書店)』▽『P・リッター著、須藤和夫・山本啓一・有坂文雄訳『リッター生化学』(1999・東京化学同人)』▽『水町邦彦著『酸と塩基』(2003・裳華房)』▽『森本安夫著『ザ・ペーハー あなたのはいくつ?』(2003・新風舎)』
改訂新版 世界大百科事典 「緩衝溶液」の意味・わかりやすい解説
緩衝溶液 (かんしょうようえき)
buffer solution
単一の塩を含む水溶液(たとえば塩化ナトリウム水溶液)に強酸または強塩基を加えると,溶液のpHは,酸または塩基の添加量から計算される値にほぼ等しいだけ変化する。しかし,弱酸とその塩,または弱塩基とその塩を含む溶液の場合には,少量の強酸や強塩基を添加してもpHがごくわずかしか変化しない。すなわち,後者の場合には,溶液中の水素イオンの濃度をできるだけ一定に保とうとする能力(緩衝能)があるわけで,このような溶液を緩衝溶液または緩衝液という。一般に,ある酸とその共役塩基との混合物を用いるとpHについての緩衝溶液をつくることができる。たとえば,第一リン酸塩/第二リン酸塩,アンモニア/塩化アンモニウム,酢酸/酢酸ナトリウム,フタル酸/フタル酸塩,イミダゾール/イミダゾール塩酸塩などがその例である。たとえば,酢酸CH3COOHのような弱酸と,その塩の酢酸ナトリウムCH3COONaを含む水溶液の場合は,塩酸HClを加えても,塩酸は酢酸ナトリウムと反応して,ほとんど電離しない弱酸である酢酸に変わるのでpH値はほとんど下がらない。
CH3COONa+H⁺Cl⁻─→CH3COOH+Na⁺Cl⁻
水酸化ナトリウムNaOHを加えた場合には,酢酸を中和するだけにとどまるためpH値が上がらない。
CH3COOH+Na⁺OH⁻─→CH3COO⁻Na⁺+H2O
化学反応や生化学反応の機構や速度はpHの変化に敏感なことが多いので,これらの反応を利用して合成や分析などを行うときには緩衝溶液を用いてpHを制御することが重要である。生物の組織や体液は,天然の有機酸や無機酸ならびにそれらの塩類を含んでいて,かなりの程度の緩衝能をもっている。溶液中の水素イオン濃度を一定に保つpH緩衝液のほかに,金属イオンに対して緩衝能のあるもの(金属イオン緩衝液)や,酸化還元電位を一定に保つ能力をもつ酸化還元緩衝液などをつくることもできる。
執筆者:玉虫 伶太
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
ブリタニカ国際大百科事典 小項目事典 「緩衝溶液」の意味・わかりやすい解説
緩衝溶液
かんしょうようえき
buffer solution
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「緩衝溶液」の意味・わかりやすい解説
緩衝溶液【かんしょうようえき】
出典 株式会社平凡社百科事典マイペディアについて 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...