精選版 日本国語大辞典 「化学平衡」の意味・読み・例文・類語
改訂新版 世界大百科事典 「化学平衡」の意味・わかりやすい解説
化学平衡 (かがくへいこう)
chemical equilibrium
可逆的な化学反応で正反応と逆反応の速度が等しくなり,あたかも反応が停止したようにみえる状態をいう。たとえば酢酸とエチルアルコールとの反応で,反応がある程度進むと,その反応は見かけ上停止する。これは,次の化学反応式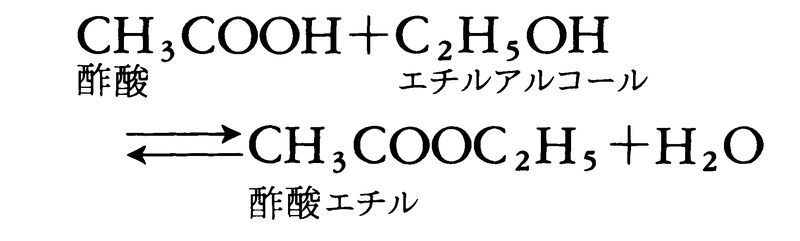
における右向きの反応(エステル化反応)と左向きの反応(加水分解)の速度が等しくなった動的釣合いの状態で,これが化学平衡である。化学平衡に達したとき,反応系の初めの組成によらず次の平衡濃度の比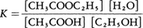 は温度のみによる定数となる。これを平衡定数という。この関係は〈質量作用の法則〉と呼ばれ,1864年C.M.グルベルグとP.ボーゲにより反応速度に基づく考察から提出され,J.H.ファント・ホフにより一般化され,熱力学に基づいて証明された。熱力学第2法則によれば,定温・定圧で反応系のギブズの自由エネルギーが減少する方向に反応が進む。自由エネルギーGが与えられた条件で極小値を示すとき,系は巨視的な変化を起こさず,これが化学平衡の条件となる。極小条件dG=0から,反応の標準自由エネルギー変化⊿G0は
は温度のみによる定数となる。これを平衡定数という。この関係は〈質量作用の法則〉と呼ばれ,1864年C.M.グルベルグとP.ボーゲにより反応速度に基づく考察から提出され,J.H.ファント・ホフにより一般化され,熱力学に基づいて証明された。熱力学第2法則によれば,定温・定圧で反応系のギブズの自由エネルギーが減少する方向に反応が進む。自由エネルギーGが与えられた条件で極小値を示すとき,系は巨視的な変化を起こさず,これが化学平衡の条件となる。極小条件dG=0から,反応の標準自由エネルギー変化⊿G0は
⊿G0=-RT lnK
となる。ここでRは気体定数,Tは絶対温度である。すなわち標準自由エネルギー変化⊿G0の値によって化学平衡における系の組成が定まることになる。触媒は化学平衡に影響を与えることはないが,反応速度が極端に小さく反応系が偽平衡にあるとき,触媒を加えることにより容易に真の平衡に達することがある。平衡定数に対する温度の影響はファント・ホフの定圧平衡式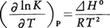 で示される。ここで⊿H0は標準反応熱で,⊿H0<0(発熱)であれば,温度が高くなると平衡定数は減少し,⊿H0>0(吸熱)であれば,温度が高くなると平衡定数は増大する。このことは,発熱反応は低温ほど,逆に吸熱反応は高温ほど進むことを示し,また一定温度で平衡に達した反応系の温度を変化させるとき,その変化を打ち消すように反応が進み新しい平衡に達することを意味する。均一気相系の反応における平衡定数に対する圧力の影響についても類似の関係が成り立つ。反応により体積が減少する反応は高圧ほど,逆に体積が増加する反応は低圧ほど進み,また化学平衡に達した系の圧力を変化させると,その影響を打ち消す方向に反応が進み新しい平衡に達する。これらの関係は平衡移動の法則と呼ばれ,平衡状態の安定性を示す〈ル・シャトリエの法則〉の一つの例である。気-液,気-固などの異なる相間での不均一化学反応に対しても平衡の法則はそのまま成り立ち,たとえば密閉容器内での炭酸カルシウムの分解反応
で示される。ここで⊿H0は標準反応熱で,⊿H0<0(発熱)であれば,温度が高くなると平衡定数は減少し,⊿H0>0(吸熱)であれば,温度が高くなると平衡定数は増大する。このことは,発熱反応は低温ほど,逆に吸熱反応は高温ほど進むことを示し,また一定温度で平衡に達した反応系の温度を変化させるとき,その変化を打ち消すように反応が進み新しい平衡に達することを意味する。均一気相系の反応における平衡定数に対する圧力の影響についても類似の関係が成り立つ。反応により体積が減少する反応は高圧ほど,逆に体積が増加する反応は低圧ほど進み,また化学平衡に達した系の圧力を変化させると,その影響を打ち消す方向に反応が進み新しい平衡に達する。これらの関係は平衡移動の法則と呼ばれ,平衡状態の安定性を示す〈ル・シャトリエの法則〉の一つの例である。気-液,気-固などの異なる相間での不均一化学反応に対しても平衡の法則はそのまま成り立ち,たとえば密閉容器内での炭酸カルシウムの分解反応
CaCO3(s)⇄CaO(s)+CO2(g)
で,CaCO3,CaOはそれぞれ純粋な固相(sで表す)をつくるので,この系の平衡定数は気相(gで表す)CO2の平衡分圧に等しくなる。これをCaCO3の解離圧ともいう。
→解離 →化学反応
執筆者:妹尾 学
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「化学平衡」の意味・わかりやすい解説
化学平衡
かがくへいこう
chemical equilibrium
化学反応が原系から生成系に向かっておこっている場合、十分に時間がたったあとでは、その化学反応の進行が見かけ上停止する。この状態を化学平衡という。しかし、化学平衡ではまったく反応が止まってしまったのではなく、原系から生成系に進む反応(正反応)の速さと、逆に生成系から原系に進む反応(逆反応)の速さとが、ちょうどつり合っているために、見かけ上、反応が止まっているようにみえるだけである。たとえば、A+B C+Dの反応で、正逆両反応の速度がそれぞれの化学種の濃度([ ]により濃度を表す)の積に比例するとすると、正反応の速度は
C+Dの反応で、正逆両反応の速度がそれぞれの化学種の濃度([ ]により濃度を表す)の積に比例するとすると、正反応の速度は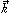 [A][B]、逆反応の速度は
[A][B]、逆反応の速度は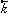 [C][D]となるから(
[C][D]となるから(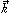 と
と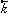 は速度定数)、平衡では
は速度定数)、平衡では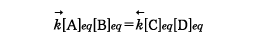
となり、したがって、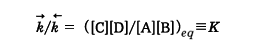
([ ]eqは平衡時の濃度を表す)すなわち、平衡に達すればこの濃度比がつねに一定値になることを表している。この関係を質量作用の法則といい、Κを平衡定数という。Κは温度が変わらない限り一定値である。
化学平衡では、このなかでおこる化学反応について、原系、生成系それぞれの自由エネルギーの和が等しくなるので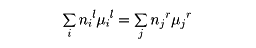
と書くことができる。ここでμilは化学反応式の左辺(l、原系)にある化学種iの化学ポテンシャル、nilは反応式中の係数を表し、右辺(r、生成系)についても同様に表す。これから
ΔG0=-RTlnK
の関係が導かれる(ΔG0は反応式に従って反応がおきたときの標準自由エネルギーの増加、Rは気体定数、Tは絶対温度)。
[戸田源治郎]
『小泉正夫著『化学平衡』(1957・共立出版)』▽『渡辺啓著『化学平衡の考え方――化学反応はどこまで進むか』(1998・裳華房)』▽『神崎凱・千熊正彦・黒澤隆夫著『化学平衡と分析化学』第2版(2003・廣川書店)』
百科事典マイペディア 「化学平衡」の意味・わかりやすい解説
化学平衡【かがくへいこう】
→関連項目オストワルト|可逆反応|質量作用の法則|反応速度|平衡
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「化学平衡」の解説
化学平衡
カガクヘイコウ
chemical equilibrium
可逆反応において正逆両方向ともに反応が進行しなくなった釣合いの状態.定温・定圧下の反応では平衡状態において,この反応系全体のギブズエネルギーは系の組成変化に対して極小値となり,また反応系の全物質のギブズエネルギーの総和と生成系のそれとは等しい.化学平衡に関与している各物質の濃度,または分圧は平衡定数によって関係づけられる.一般に化学平衡の位置は,温度を高くすると吸熱の方向に移動する.また,圧力を高くするとこの効果を減殺する方向に移動するが,平衡定数そのものは一定温度では全圧に無関係に一定である.[別用語参照]ルシャトリエ-ブラウンの法則,ファントホッフの式
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
最新 地学事典 「化学平衡」の解説
かがくへいこう
化学平衡
chemical equilibrium
熱力学における平衡のうち,化学反応・分配・相変化など物質の化学的変化に関する平衡。代表的例としてA+B⇌C+Dで表される化学反応の場合,左辺の反応物が右辺の生成物に変化する速度が,生成物が逆に反応物に戻る速度と等しく,見かけ上反応の進行が止まった状態。そのとき,反応物の化学ポテンシャルの総和が生成物のそれと等しく,気相や溶液では各成分の分圧や濃度の関係が平衡定数で規制される。
執筆者:松葉谷 治
出典 平凡社「最新 地学事典」最新 地学事典について 情報
ブリタニカ国際大百科事典 小項目事典 「化学平衡」の意味・わかりやすい解説
化学平衡
かがくへいこう
chemical equilibrium
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「化学平衡」の解説
化学平衡
世界大百科事典(旧版)内の化学平衡の言及
【化学反応】より
…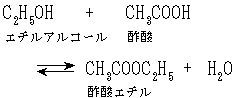 1864年,ノルウェーのC.M.グルベルグとP.ボーゲは,式(1)の平衡において,平衡点は水に可溶な反応物質(K2CO3,K2SO4)の量でほぼ決まってしまうことを見いだし,平衡状態を決定するのは質量以外に容積であるという考えに到達した。他の条件が等しければ反応の駆動力は反応物の活性質量の積に比例し,化学平衡の状態は正方向の反応と逆方向の反応の駆動力が等しいときに出現すると考えた。
1864年,ノルウェーのC.M.グルベルグとP.ボーゲは,式(1)の平衡において,平衡点は水に可溶な反応物質(K2CO3,K2SO4)の量でほぼ決まってしまうことを見いだし,平衡状態を決定するのは質量以外に容積であるという考えに到達した。他の条件が等しければ反応の駆動力は反応物の活性質量の積に比例し,化学平衡の状態は正方向の反応と逆方向の反応の駆動力が等しいときに出現すると考えた。
[化学親和力の意味]
グルベルグ,ボーゲの考えにはニュートンの力学の影響がみられ,化学親和力も一種の力と考えられ,化学反応が起こるためには反応体が相互に力の及ぶ範囲にまで接近することが必要であり,活性質量とはこの力の及ぶ範囲(作用球)にある量で,濃度にほぼ対応する。…
※「化学平衡」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

