精選版 日本国語大辞典 「酸化還元電位」の意味・読み・例文・類語
日本大百科全書(ニッポニカ) 「酸化還元電位」の意味・わかりやすい解説
酸化還元電位
さんかかんげんでんい
oxidation-reduction potential
電子移動で共役関係にある酸化体と還元体の溶液に、白金板のような不可侵電極(それ自身は酸化還元反応に関与しない不活性な物質の電極)を浸したときに現れる電位で、標準電極電位と同じく標準水素電極との電位差で表す。酸化体をOx、還元体をRedとし、それらが、
Ox+ne Red (1)
Red (1)
の関係にあるとき、OxとRedの活量をaO、aRとすれば、酸化還元電位Eは
E=E0-(RT/nF)loge(aR/aO) (2)
で与えられる。ここでRは気体定数、Tは熱力学温度(絶対温度)、Fはファラデー定数で、E0はaR=aO=1の場合の電位であり、標準酸化還元電位という。
一般に標準酸化還元電位の高い系での酸化体は強力な酸化剤であり、低い系での還元体は強力な還元剤となる。また、(1)、(2)の表現で与えられる電位を単に還元電位reduction potentialとよび、(1)の左右を交換して(2)の符号が逆転する表現で与えられる電位を酸化電位oxidation potentialということもあるが、現在では還元電位による方式が広く採用されている。
[岩本振武]
改訂新版 世界大百科事典 「酸化還元電位」の意味・わかりやすい解説
酸化還元電位 (さんかかんげんでんい)
oxidation-reduction potential
redox potential
酸化還元電極の平衡電極電位で,酸化電位oxidation potentialとも呼ばれる。標準水素電極に対して測った値で表すのが普通である。酸化還元反応
Ox+ne⁻⇄Red
(e⁻は電子,nは反応に関与する電子の数)に対する酸化還元電位Eは
E=E°-(RT/nF)ln(aRed/aOx)
で与えられる。ここで,Rは気体定数,Fはファラデー定数,Tは絶対温度,aRedおよびaOxはそれぞれ還元体Redおよび酸化体Oxの活動度(活量),またE°はこの電極反応の標準電極電位で,これを標準酸化還元電位という。E°の値が正で大きいほど酸化体Oxの酸化力が強く,逆にE°が負の大きな値であるほど還元体Redの還元力が強い。それゆえ,ある酸化還元系を含む溶液の酸化力を表すのに酸化還元電位を用いることができる。すなわち,酸化還元電位の高い系ほど酸化力が強い。酸化還元電位のおよその値を簡単に知るには酸化還元指示薬を用いればよい。
執筆者:玉虫 伶太
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
最新 地学事典 「酸化還元電位」の解説
さんかかんげんでんい
酸化還元電位
oxidation-reduction potential ,redox potential
化学種間の電子の授受(酸化還元反応)によって生ずる電位。酸化電位とも。溶液の酸化・還元能力を表す目安となる量。酸化還元反応を次のような一般式で示す。Red=Ox+ne。ここでRedは還元体の,Oxは酸化体の化学種を表し,nは移動する電子数を示す。このとき電極電位Ehはネルンストの式として知られる次式で表される。Eh=E0+(RT/nF)ln(Ox/Red)。ここでRは気体定数,Fはファラデー定数である。E0は標準酸化電位といい,OxとRedがそれぞれ単位の活動度をとったときの電位である。Ehは通常,還元形である金属とその金属のイオン(酸化形)を含む溶液との間に発生する起電力を,標準電極として用いられる水素電極との間の電位差として測定される。Ehの大きさは酸化能力の大きさを示す。天然における水溶液中で酸化還元および水素イオン濃度により支配される溶存イオン種および鉱物の安定関係はEh-pH図を用いて表すことができる。Eh-pH図は堆積性鉄鉱床・マンガン鉱床・ウラン鉱床・熱水鉱床の成因,二次富化作用の過程などの研究に利用されている。
執筆者:日下 部実・島田 寛一
出典 平凡社「最新 地学事典」最新 地学事典について 情報
化学辞典 第2版 「酸化還元電位」の解説
酸化還元電位
サンカカンゲンデンイ
redox potential
電極反応は,一般には酸化体Oと還元体Rの反応で表される.すなわち,
O + ze  R(zは荷電数)
R(zは荷電数)
また,その平衡電極電位はネルンストの式で表される.
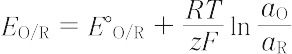
ここで,aO,aR はそれぞれ酸化体,還元体の活量である.OおよびRがいずれもイオンあるいは可溶性物質の場合,その可逆電位を酸化還元電位といい,E°O/R を標準酸化還元電位とよぶ.上式からわかるように,酸化還元電位は,OおよびRの濃度比にのみ依存し,電極材質には関係しないが,測定に際しては,化学的に安定であり,かつ電極として活性で安定な電位を示す白金が電極として用いられる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「酸化還元電位」の意味・わかりやすい解説
酸化還元電位
さんかかんげんでんい
oxidation-reduction potential
E=E0+(RT/nF) ln (a0/ar)
ここで a0 ,ar は酸化体,還元体の活量,n は授受電子数,R は気体定数,T は絶対温度,F はファラデー定数,E0 は標準酸化還元電位である。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
岩石学辞典 「酸化還元電位」の解説
酸化還元電位
百科事典マイペディア 「酸化還元電位」の意味・わかりやすい解説
酸化還元電位【さんかかんげんでんい】
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「酸化還元電位」の解説
酸化還元電位
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

