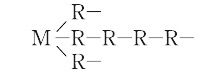配位説
はいいせつ
coordination theory
高次化合物の構造、結合状態を説明するために、スイスのA・ウェルナーが唱えた考え方をいう。配位結合や配位化合物についての本質は、現在解明されているが、古くは、いわゆる錯塩をはじめとして種々の高次化合物についての意義がわからず、多くの疑問のなかにあった。これを整理し、現在の無機立体化学の基礎となる考え方をつくりあげたのがウェルナーである。
[中原勝儼]
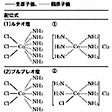
彼は1893年高次化合物の構造、結合状態について次のような考え方を提唱した。たとえば、いわゆる一次化合物の分子中では、原子と原子との間の結合は、通常の原子価結合によって結合しているが、さらに高次化合物をつくるのには、それらの分子間に働く結合力があるとした。そのときの一次化合物のなかでの結合を主原子価、一次化合物どうしにさらに働く結合を側原子価とよび、前者を実線、後者を点線で表すと、当時わかりにくかったコバルトや白金などの錯塩の構造が理解されることになり、次のように表されていたルテオ塩(黄褐色の塩の意)CoCl3・6NH3、プルプレオ塩(赤紫色塩)CoCl3・5NH3、ロゼオ塩(バラ色塩)CoCl3・5NH3・H2O、ビオレオ塩(紫色塩)CoCl3・4NH3などは図のようになる。さらに、これらの塩の冷水溶液に硝酸銀を加えたときに沈殿する塩素の数、すなわちイオン化できる塩素の数は、(1)および(3)では3、(2)では2、(4)では1とわかっているので、イオン化するClを区別して書くと(配位子を中心金属の周辺に配列)、図のように(1)は①、(2)は②、(3)は③、(4)は④となり、元の成分とまったく異なった複雑な陽イオン、すなわち錯イオンと、イオン化する塩化物イオンからなる式が得られる。
このような構造式を配位式coordination formulaというが、ウェルナーは配位式中のコバルト原子などを中心原子とよび、これを取り巻くNH3やH2O,Cl-など、単原子イオンあるいは原子団、すなわち配位子が、中心原子を中心としてできるだけ対称的な位置を占めるものと考え、これを「配位する」(coordinate)といった。このような配位という概念に基づいて、各種の錯塩を調べると、中心原子を取り巻く配位子の数(配位数)は、多くの場合6または4であることがわかった。そこで配位数6の場合、配位子は中心原子に対してどのような位置を占めるかを考え、各種の対称的図形を検討し、異性体のでき方からその形を決定した。すなわち、中心原子を三次元直交座標の原点に置くとき、六つの配位子は三つの座標軸上の正および負方向への等距離の点、つまり原点を中心とする正八面体の六つの頂点に位置すると結論した。配位数4のときは、同じく正四面体の四つの頂点に位置するときと、正方形の四頂点にある場合との二つがある。その他の配位数の場合にもそれぞれの空間配置が考えられている。
以上がウェルナーの配位説の大要で、それまでまったく不明であった無機化合物の立体構造の解明の端緒となったものということができる。しかし発表された当時は多くの反対論もあり、かならずしも最初から受け入れられたわけではない。ウェルナーはそれらの反論を一つずつ実験的証明によって打ち破り、とくに八面体型空間配置から予想される光学異性の実在の証明を行い、配位説の正しいことを確固たるものとした。彼はこの功績により1913年ノーベル化学賞を受賞している。またこのような空間配置の正しいことは、その後X線、電子線、中性子線などを用いる構造解析によって直接確かめられており、配位説ということばはすでに古典的なものとなっており、現在では配位理論といっている。なお、先の例にあげた主原子価、側原子価の概念は、結合論の進歩に伴い、なんら区別する必要もなく、現代的な共有結合の概念に置き換えられてはいるが、空間的な方向性をもって配位するという配位説の根本的な考え方は、そのまま現在も通用している。
[中原勝儼]
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
配位説 (はいいせつ)
coordination theory
高次化合物の構造および結合状態について,ドイツのA.ウェルナーが1893年提出した考え方。その後部分的には修正されたが,基本的な考え方は正しいことが明らかになり,現在では配位理論と呼ばれている。
19世紀も後半になると,炭素の四面体4価という原子価理論や,ベンゼン環の六角形構造が明らかにされ,各種有機化合物の構造が解明されて,その立体化学が発展してきた。これに対し,無機化合物については各種元素の多様性のために,化学結合や構造については合理的な説明がなされていなかった。そのなかでもアンモニア和物や水和物のような高次化合物,たとえばCoCl3・6NH3,CoCl3・5NH3,CoCl3・4NH3,CoCl3・5NH3・H2Oなどの場合に,古典的な原子価理論ではいちおう原子価が満たされているはずのCoCl3とNH3やH2Oとの間の結合がどのようなものであるかがわかっていなかった。ウェルナーはこれらの場合,陰イオンのような酸基(この場合Cl⁻),NH3やH2Oなどの分子が配位子として中心金属イオンのまわりに八面体形6配位となって取り巻くことになるとした。分子などが配位圏内では金属原子に対して同格に結びつくという意味でcoordinateという言葉が使われ,日本では配位と訳されるようになった。この配位説によって説明できる化合物のことを錯化合物あるいは配位化合物と呼ぶ。ウェルナーは金属イオンの酸化状態を示すふつうの原子価(主原子価)が飽和されているのに,なおH2O,NH3などの余分の分子などが中心イオンに結合できるのは,一定の方向性をもつ側原子価なるものがあるからだと考えたが,その本質については当時の結合論ではなお説明がつかなかった。しかしこれによって前記の化合物の立体構造は図のようなものであることになり,CoCl3・4NH3でみられるプラセオ塩(緑色塩の意)とビオレオ塩(紫色塩の意)は異性体であることも説明できることになった。その後の研究で主原子価と側原子価の結合の性質にはなんら本質的な違いがあるわけではなく,形式的ないわゆる配位結合による違いのみであることがわかっている。
執筆者:中原 勝儼
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Sponserd by 
配位説
ハイイセツ
coordination theory
1893年,A. Werner(ウェルナー)は最初の論文において,錯体の構造をはじめてMR6型の立体構造式で表し,それまでのC.W.Blomstrand-S.M.Jφrgensenの鎖状構造式(図)とは本質的に異なった,現在の八面体型構造の構想を提示した.これを配位説という.そして,1金属原子の周囲に6個の原子または原子団をもつ錯基においては,これらの原子,原子団は正八面体の頂点に配置され,これを配位座と命名して,配位説の基本的見解を展開した.たとえば,CoCl3・6NH3でコバルトのイオン原子価は+3で,6個のNH3が正八面体型にコバルトイオンのまわりに配位していることになる.同様の推論はMR4型錯体の立体構造についても行われた.これからWernerは主原子価,側原子価の概念や,八面体型構造の具体的根拠となるヘキソール塩の実験へと発展させ,配位説を完成し,現在の錯体構造化学の基礎を築いた.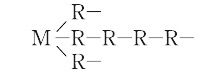
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
Sponserd by 
配位説
はいいせつ
coordination theory
金属錯体の性格について,1893年 A.ウェルナーが提出した学説。これによりウェルナーは 1913年ノーベル化学賞を授与された。この学説は無機化学においても,また原子価の概念においても指導原理となった。配位説は次のように要約される。
(1) 多くの元素は主原子価と副原子価あるいは側原子価の2つの型の原子価を示す (現代の概念では前者は酸化状態,後者は配位数に相当) 。
(2) どの元素も主原子価と副原子価の両方を満足させようとする傾向がある。
(3) 副原子価は中心イオンの周囲で一定の方向をもつ。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by 
世界大百科事典(旧版)内の配位説の言及
【化学】より
…彼らの唱えた炭素正四面体説(1874)は,分子内の原子の配列を三次元的にとらえる立体化学の基礎となった。A.ウェルナーは,遷移金属がつくるある種の化合物においては,金属原子は単純な原子価説では説明できない原子価をもつことを説明する〈配位説〉を提案した。配位説は20世紀に開花した錯体化学への道を開いた。…
※「配位説」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
Sponserd by