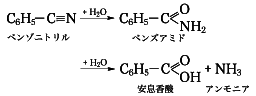カルボン酸(読み)カルボンサン(その他表記)carboxylic acid
精選版 日本国語大辞典 「カルボン酸」の意味・読み・例文・類語
カルボン‐さん【カルボン酸】
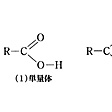
- 〘 名詞 〙 ( [英語] carboxylic acid の訳語 ) 酢酸(CH3COOH)やギ酸(HCOOH)など、分子中にカルボキシル基をもつ有機化合物。一般式は RCOOH または RCO2H で表わす。
日本大百科全書(ニッポニカ) 「カルボン酸」の意味・わかりやすい解説
カルボン酸
かるぼんさん
carboxylic acid 英語
Carbonsäure ドイツ語
カルボキシ基(カルボキシル基)-COOHをもつ有機化合物を、一般にカルボン酸といい、一般式RCOOHあるいはRCO2Hで表す。カルボキシル酸ということもある。カルボキシ基の水素は解離して酸性を示すので、カルボン酸の名が与えられている。
[廣田 穰・末沢裕子]
分類
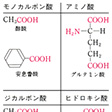
カルボン酸はカルボキシ基の数により分類することができ、カルボキシ基を1個もつものをモノカルボン酸、2個もつものをジカルボン酸、3個もつものをトリカルボン酸という。
鎖状のモノカルボン酸は、脂肪や油脂の成分として広く分布しているので、とくに脂肪酸といわれる。またカルボキシ基のほかに、アミノ基をもつカルボン酸をアミノ酸、ヒドロキシ基をもつカルボン酸をヒドロキシ酸(オキシ酸)、ケトンのカルボニル基をもつカルボン酸をケト酸(ケトン酸)という。
[廣田 穰・末沢裕子]
命名法
カルボン酸の名称としては慣用名がよく用いられている。そして、それらは構造に由来する名称ではなく、所在や天然から最初に得られた際の原料などに由来する名称であることが多い。たとえば、ギ酸の場合は、英語名がformic acidであるが、これはアリ(ラテン語formica)に含まれている酸であることに基づいて命名され、酢酸acetic acidは酢(す)(ラテン語acetum)の中に3~4%含まれている。また、こはく(ラテン語succinum)を乾留すると得られるジカルボン酸はコハク酸succinic acidと名づけられ、牛乳が腐って酸っぱくなったときにできる酸はラテン語の乳lactから乳酸lactic acidの名でよばれる。
第一のIUPAC命名法では、まず、名前をつけたいカルボン酸がもっているカルボキシ基-COOHをメチル基CH3に置きかえた炭化水素名をつくり、続いてこの炭化水素名の語尾に「酸」をつけると、カルボン酸の名前ができあがる。いいかえるとカルボン酸と同じ数の炭素をもつ炭化水素名に「酸」をつけると「カルボン酸」の名前になる。吉草酸のIUPAC名は、吉草酸の化学式CH3-CH2-CH2-CH2-COの-COOHを-CH3-に置きかえるとCH3-CH22-CH2-CH2-CH3になり、これはC5炭化水素の「ペンタン」である。したがって吉草酸はその語尾に「酸」をつけて、「ペンタン酸」になる。英語名の場合は炭化水素名「pentane」の語尾の「e」を「oic acid」にかえて「pentanoic acid」と命名する。この命名法は鎖式の脂肪族カルボン酸の命名にはしばしば使われるが、その他のカルボン酸の命名には、あまり使われない。
これにかわって、-COOH基を「カルボン酸」という名前の置換基として取り扱い、骨格の名前の後につける命名法が広く使われている。たとえば、シクロペンタンc-C5H10の水素1個を-COOHで置き換えたc-C5H9-COOHは「シクロペンタンカルボン酸」とよばれ、ベンゼンC6H6の水素1個を-COOHで置き換えたC6H5-COOHはベンゼンカルボン酸(安息香酸という慣用名もある)とよばれる。この命名法を用いると化合物が「カルボキシ基をもっていてカルボン酸の性質を示す」ことが名前からはっきりわかる利点があるので、よく使われる。
「カルボン酸」(接尾語)のかわりに「カルボキシ」(接頭語)を骨格名の前につけて、カルボン酸を表す命名法もある。この命名法はカルボキシ基だけをもつカルボン酸に使われることは少ないが、塩化[(2-カルボキシ)エチル]トリメチルアンモニウム[(CH3)3NCH2CH2COOH]+Cl-の例のように、2種類以上の置換基がある場合には、ときとして使われる。
[廣田 穰・末沢裕子]
所在と重要性
カルボン酸は、脂肪ないしは油脂の重要な構成成分として、広く動植物界に分布している。動植物から得られるカルボン酸の種類は多いが、その大部分は飽和および不飽和の直鎖カルボン酸である。油脂・脂肪などとよばれている動植物油はほとんどすべてが、3価アルコールのグリセロール(グリセリン)のエステルとして存在する。カルボン酸とグリセロールとのエステルはグリセリドとよばれている。動植物油を構成しているカルボン酸は、炭素数16および18のものが多く、不飽和カルボン酸を多く含む植物油は液体で、食品として栄養的に優れている。炭素数が少ない酢酸は、食酢の成分として3%ほど含まれている。酢酸、酪酸などのカルボン酸と一価アルコールとのエステルは芳香があり果実中に存在し、合成物は食品の着香料・フレーバーとしての用途がある。
また、リンゴ酸、クエン酸など多くのジカルボン酸・トリカルボン酸は、生体内において栄養物質をエネルギーに変える代謝回路において重要な役割を果たしている。この回路はトリカルボン酸回路(TCA回路、クレブスKrebs回路)と名づけられている。前述のように、カルボン酸は生物の生活活動と密接な関係があり、微生物が発酵によりつくりだす場合も多い。アセトバクターによる酢酸、クモノスカビの一種によるフマル酸を生成する発酵は有名で、工業的にも利用されている。
[廣田 穰・末沢裕子]
製法
大別すると、(1)アルコール、アルデヒドなどの酸化により、すでにある炭素原子をカルボキシ基に変える方法と、(2)有機金属化合物のカルボキシル化などにより新たにカルボキシ基を導入する方法と、(3)ハロゲン化合物をシアノ基-C≡Nにより置換しそれに続いて加水分解する方法がある。
[廣田 穰・末沢裕子]
(1)アルコール、アルデヒドなどの酸化
第一アルコールまたはアルデヒドの酸化によってカルボン酸を得ることができる。たとえば、ひまし油からとれるヘプタナールはn-ヘプタン酸の原料となる。
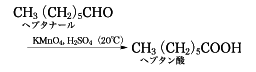
アルデヒドの酸化による方法は、工業的に酢酸をつくる際に利用され、エチレンの水和で得られるアセトアルデヒドを酸化することにより酢酸を合成している。
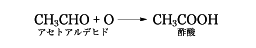
二重結合の炭素上に1個以上の水素をもつアルケンの酸化によってもカルボン酸が得られるが、アルケンが非対称の場合には、2種のカルボン酸の混合物となる。
実験室でカルボン酸を合成するのに利用できる酸化反応としてハロホルム反応がある。アセチル基をもつ化合物(RCOCH3)を水酸化ナトリウムなどのアルカリの存在下で分子状ハロゲン(Cl2,Br2,I2)によりハロゲン化すると、トリハロアセチル化合物(RCOCX3:X=Cl,Br,I)が主生成物として得られ、これを水酸化アルカリにより加水分解すると、カルボン酸のアルカリ塩RCOOM(M=Na、K)とハロホルムCHX3が生成する。この反応ではアセチル基の一つ目の水素のハロゲン化に比べて二つ目の水素のハロゲン化のほうが速く、三つ目のハロゲン化がさらに速く進むということを利用している。ハロゲン化にCl2を用いた場合にはハロホルムとしてクロロホルムCHCl3、Br2の場合にはブロモホルムCHBr3、I2の場合にはヨードホルムCHI3が生成する。
ヨードホルムは黄色の固体で特有のにおいをもっているので、この反応をアセチル基の検出に使う場合には便利であるが、カルボン酸合成の目的でこの反応を行う場合は、塩素または臭素とアルカリを用いるのが普通である。この反応はアセチル基だけでなく、酸化するとアセチル基になる1-ヒドロキシエチル基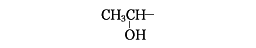
をもつ化合物にも応用できる。
[廣田 穰・末沢裕子]
性質
カルボン酸の特徴として第一にあげなければならないのは、その酸性である。酸性は、カルボキシ基の水素が水溶液中で次の解離をおこしてヒドロニウムイオン(水素イオン)を生ずることによる。
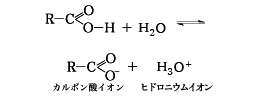
したがって、酸の強さは水素イオンの生成のしやすさの度合いによって決まり、解離定数が大きいほど酸性が強い。もっとも代表的なカルボン酸である酢酸の解離定数Kaは0.0000175で、わずかに解離する弱い酸である。このKa値から求めると、1モル溶液は0.4%解離しているにすぎず、これに反して塩酸、硫酸などは薄い溶液中でほとんど完全に解離し、解離定数は1よりも大きい。炭酸は酢酸よりもっと弱い酸である。酢酸ナトリウムに塩酸を作用させると酢酸が遊離するが、炭酸水素ナトリウムに酢酸を作用させると二酸化炭素が気体として発生することによって、酢酸の酸性は塩酸より弱いが、炭酸より強いことがわかる。酸の解離定数Kaをそのまま用いていろいろな酸の強さを比べようとすると、その数値が広範囲に変化して比べにくいので、解離定数の対数に負号(マイナス)をつけたpKa値(pKa=-log10Ka)がよく用いられる。酢酸のpKa値は4.76である。
カルボン酸が酸性を示すのは、カルボキシ基のO-H結合が切れて-COO-とH+を生成しやすいからである。他のヒドロキシ基に比べてカルボキシ基のO-H結合だけが解離しやすいおもな理由は二つある。その一つは、電子を引き寄せる性質が大きいカルボニル基にヒドロキシ基が結合していることである。カルボニル基がヒドロキシ基の酸素上の電子を引き寄せるので、その酸素上の電子密度が低くなって水素原子の電子を引き付ける。したがってO-H結合をつくっている電子は、酸素のほうに引き付けられて水素原子の周りの電子は少なくなり、H+として離れやすくなる。このような効果を誘起効果とよんでいる。
もう一つの理由は、解離してできたカルボン酸陰イオンが共鳴により安定していることによる。カルボン酸の解離は、できるイオンにおいて負の電荷が多くの原子上に分散していて安定化しているほどおこりやすい。カルボン酸ではカルボキシ基の炭素と二つの酸素原子とを結ぶ結合(C-OとC=O)は、長さが違い、非対称である。これと対照的にカルボン酸イオンになると、共鳴により両者は等しい長さになり、負電荷は二つの酸素原子上に均等に分布して安定化する。
[廣田 穰・末沢裕子]
酸の強さ
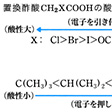
カルボン酸のpKa値はのとおりである。pKa値が小さいほど酸としての解離がおこりやすく、強い酸である。酢酸からノナン酸に至る直鎖状飽和のカルボン酸の系列のpKaは4.6~5であり、アルキル基の鎖が枝分れしてもあまり影響はない。最初のギ酸は例外で、カルボキシ基にアルキル基のついたカルボン酸に比べてかなり酸性が強い。表中第2および第3群の酸のpKaをみると、ハロゲン、ヒドロキシ基その他の基で置換されると酸性が強くなることがわかる。酸性が強くなる理由も、先に述べた誘起効果の考え方で説明できる。酢酸のα(アルファ)-水素1個を塩素と置換すると酸性は著しく増加し、クロロ酢酸CH2ClCOOHではpKaは2.81である。塩素は強く電子を引き付ける力があるので、水素が解離しやすくなる。電子を引き付ける力は臭素では塩素より弱く、ヨウ素ではさらに臭素より弱い。の置換酢酸の酸性の強さの順序は、電子を引き寄せる力の指標である電気陰性度の順序と一致する。α-クロロプロピオン酸およびβ(ベータ)-クロロプロピオン酸のpKaを比較すると、置換基Clがカルボキシ基から遠ざかるにつれて、その誘起効果が急速に減少することがわかる。α-クロロプロピオン酸は、プロピオン酸自体よりはるかに強酸性であるが、β-クロロプロピオン酸はプロピオン酸よりわずかに強いにすぎない。
酢酸のメチル基の水素を順次1個、2個、3個の塩素により置換していくとその酸性はしだいに増加し、トリクロロ酢酸の酸性は、無機酸とほとんど変わらないぐらい強くなっている。このほかにヒドロキシ基、ニトロ基なども酸性を強める作用をもっているが、アルキル基は逆に酸を弱める効果を示す。酢酸がギ酸よりも弱酸であることはメチル基が水素原子よりも電子を引き寄せる力が小さいこと、すなわち相対的にいえば、CH3→COOHの矢印で示されるように電子を押し出す力があることを示している。酢酸の高位同族体のpKaはきわめて酢酸に近い値をとるが、このことはメチル、エチルおよびそれより高位なアルキル基の電子を押し出す力の差が非常に小さいことを示している。以上の結果をまとめると置換基の種類により酸性が次の順序で変化することがわかる。
カルボン酸が()の(1)で示される単量体の分子として単独で存在するのは、水などの極性溶媒薄い溶液中だけである。カルボン酸は液体の状態ではもちろんのこと、気体またはかなり薄い溶液にしても、大部分は(2)のような2分子が結び付いた会合体(二量体)として存在する。この式で破線で示した結合は水素結合であり、酸素原子と結合しているヒドロキシ基の水素原子ともう一つカルボン酸分子のカルボニル基の酸素の間に生ずる弱い結合である。液体や固体の場合には、もっと多くのカルボン酸分子が水素結合により鎖状につながって多量体になっていることがある。
2分子が強く会合しているので、カルボン酸を沸騰させて気体にする場合でも、(2)の二量体は壊れないで残る。したがって、同程度の分子量で同じような形をしている他の種類の化合物に比べると沸点も融点も高くなっている。カルボン酸をメチルエステルやエチルエステルに変えると、分子量は大きくなるにもかかわらず、沸点も融点も下がるのが普通である。その理由はエステルにはヒドロキシ基がないので水素結合ができないからである。
[廣田 穰・末沢裕子]
反応
カルボン酸の反応性は酸としての反応、ヒドロキシ基-OHの反応、カルボニル基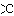 =Oの反応に分けて考えられる。
=Oの反応に分けて考えられる。
(1)酸としての反応 カルボン酸は酸性を示し、塩基と結合して塩を形成しうる点でアルコール、アルデヒド、ケトン、エーテル、エステルなどと異なる。水酸化ナトリウム、水酸化カリウムなどの強塩基とは定量的に反応して塩になる。この反応は中和滴定により酸の量を決定するのに応用されている。
RCOOH+NaOH
―→RCOONa+H2O
ナトリウムおよびカリウム塩は、イオン性の化合物であるので、その性質はカルボン酸自身と非常に異なっている。元の酸がたとえ液体であっても塩は固体であり、また、元の酸が水に不溶でも塩は可溶である。またイオン性化合物なのでエーテルなどの有機溶媒にはほとんど溶けない。酸の特性を利用して、カルボン酸を他の有機物との混合物中から分離することができる。まずカルボン酸を含む混合物をエーテルに溶かして、そのエーテル溶液と炭酸水素ナトリウム水溶液を分液漏斗(ろうと)に入れて振り混ぜると、カルボン酸は塩をつくって定量的に炭酸水素ナトリウムの水溶液層に移るから、水溶液層を分けとって硫酸などの強酸で酸性にするとカルボン酸だけを取り出すことができる。
(2)ハロゲン化 カルボン酸のヒドロキシ基を他の基に置き換える反応もいくつか知られている。これらの反応では、カルボン酸はアシル基RCO-とヒドロキシ基を結ぶC-O結合が切れて反応する。この型の反応としてよく知られているのは、ハロゲン化により酸ハロゲン化物ができる反応である。酸塩化物をつくるには五塩化リン、三塩化リン、塩化ホスホリル、塩化チオニルなどの塩素化剤を用い、酸臭化物をつくるには三臭化リンまたは臭化チオニルを用い、酸ヨウ化物をつくるには三ヨウ化リンを用いてカルボン酸をハロゲン化する。ここにあげた試薬を用いると、カルボン酸のアルキル基をハロゲン化せずに酸のヒドロキシ基だけをハロゲン化できる。

これらの酸ハロゲン化物はアシル化試薬として使われている。アシル化には酸ハロゲン化物とともに酸無水物も使われ、強酸の存在下では、カルボン酸もアシル化試薬として使うことができる。
(3)エステル化 カルボン酸のカルボキシ基のC-O結合が切れる反応としてもっとも重要なのは、エステル化の反応である。カルボン酸を過剰量のアルコール(カルボン酸と比べて多いモル数)と触媒量の濃硫酸(反応液全体のおよそ3%ぐらいの量)とを混ぜて加熱するとエステルを生成する。この方法によるエステル化は広い範囲の第一アルコールおよび第二アルコールとカルボン酸の組合せに有効である。
しかし、tert-ブチルアルコールなどの第三アルコールのエステル化は、アルコールのC-O結合が切れる別の経路で反応が進む。
(4)コルベの電解反応 カルボン酸塩の溶液に直流の電流を通すと、カルボン酸イオンは陽極に、金属イオンは陰極に向かって移動して電気分解をおこす。1例として、酢酸カリウムCH3COOKのコルベ反応を取り上げると、酢酸カリウムは水溶液中では酢酸イオンCH3COO-とカリウムイオンK+とに解離しているので、電気分解を行うと、酢酸イオンは陽極に向かい、カリウムイオンは陰極に向かって移動し電極に電荷を与えて自らは電荷を失う。陰極上で電荷を失ったカリウム(金属)はただちに水と反応して水酸化カリウムになり、K+に戻る。

陽極に1個の電子を与え電荷を失った酢酸イオンはアセトキシラジカルCH3COO・になるが、すぐにメチルラジカルCH3・と二酸化炭素CO2に分解し、できたメチルラジカルは、さらに2分子が重合してエタンCH3CH3を生ずる。
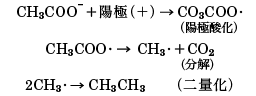
このようにカルボン酸塩を電気分解してカルボン酸の炭化水素骨格が二量化した構造の炭化水素を合成する反応をコルベ反応という。
(5)脱炭酸反応 カルボン酸を高温に加熱するとカルボキシ基が二酸化炭素として脱離して炭化水素になる。この反応は一つの炭素原子上に二つのカルボキシ基をもつマロン酸、カルボキシ基のついている炭素上にニトロ、シアノ、カルボニルなどの電子を引き寄せる性質の置換基をもつカルボン酸では100~150℃に加熱するだけで容易に進行する。
アジピン酸では、脱炭酸反応とともに環化がおこり、環状ケトンになる。脱炭酸反応はカルボン酸自体よりも、カルボン酸塩を用いるほうが実験操作が容易で、たとえば酢酸ナトリウムを水酸化ナトリウムとともに加熱するとメタンが発生し、同時に炭酸ナトリウムができる。
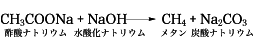
(6)カルボニル基の反応 カルボン酸のカルボキシ基の中のカルボニル基(C=O原子団)はケトンやアルデヒドのカルボニル基のようにオキシムやヒドラゾンをつくらず、また付加反応もほとんどおこさない。カルボン酸のカルボキシ基の還元は、普通の還元剤ではなかなかおこらないが、水素化アルミニウムリチウムなどの金属水素化物を用いると還元されて第一アルコールになる。
[廣田 穰・末沢裕子]
『小竹無二雄監修「脂肪族モノカルボン酸」「脂肪族ジおよびポリカルボン酸」(『大有機化学4 脂肪族化合物3』pp.141~415. 1959・朝倉書店)』▽『小竹無二雄監修「オキシ酸」「オキソ酸」(『大有機化学5 脂肪族化合物4』pp.1~161, pp.163~261. 1959・朝倉書店)』▽『塩田三千夫著『基礎化学選書4 官能基の化学』(1982・裳華房)』▽『大嶌幸一郎著『基礎有機化学』(2000・東京化学同人)』▽『Saul PataiThe chemistry of carboxylic acids and esters(1969, Interscience Publishers, London and New York)』
改訂新版 世界大百科事典 「カルボン酸」の意味・わかりやすい解説
カルボン酸 (カルボンさん)
carboxylic acid
カルボキシル基-COOHをもつ有機化合物の総称で一般式RCOOHで表される。カルボキシル基が1個のものをモノカルボン酸,2個のものをジカルボン酸,3個のものをトリカルボン酸と呼ぶ。また,炭化水素基Rの種類によって,脂肪族カルボン酸,芳香族カルボン酸とか飽和カルボン酸,不飽和カルボン酸などという。分子内に環式構造をもたない鎖式のモノカルボン酸を脂肪酸という。カルボキシル基以外に水酸基-OH,アミノ基-NH2,カルボニル基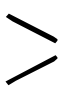 C=O等をもつものをそれぞれヒドロキシ酸(オキシカルボン酸,オキシ酸ともいう),アミノ酸,ケト酸などと呼ぶ。カルボン酸のなかには古くから知られているものが多いために,ギ(蟻)酸,酢酸,安息香酸と慣用名で呼ばれるものが多いが,複雑なものについては組織的命名法である国際命名法(IUPAC命名法)が用いられている。その一つは,カルボキシル基の代りにメチル基を入れた炭化水素を考え,その炭化水素名の後に〈酸-oic acid〉をつけ。たとえば,酢酸CH3COOHはエタン酸ethanoic acid,コハク酸HOOCCH2CH2COOHはブタン二酸butane-dioic acidという。もう一つは,炭化水素残基Rの名称の後に〈カルボン酸-carboxylic acid〉をつける。この方法によれば,酢酸CH3COOHはメタンカルボン酸methane-carboxylic acidと命名される。
C=O等をもつものをそれぞれヒドロキシ酸(オキシカルボン酸,オキシ酸ともいう),アミノ酸,ケト酸などと呼ぶ。カルボン酸のなかには古くから知られているものが多いために,ギ(蟻)酸,酢酸,安息香酸と慣用名で呼ばれるものが多いが,複雑なものについては組織的命名法である国際命名法(IUPAC命名法)が用いられている。その一つは,カルボキシル基の代りにメチル基を入れた炭化水素を考え,その炭化水素名の後に〈酸-oic acid〉をつけ。たとえば,酢酸CH3COOHはエタン酸ethanoic acid,コハク酸HOOCCH2CH2COOHはブタン二酸butane-dioic acidという。もう一つは,炭化水素残基Rの名称の後に〈カルボン酸-carboxylic acid〉をつける。この方法によれば,酢酸CH3COOHはメタンカルボン酸methane-carboxylic acidと命名される。
天然には,遊離の酸,またはエステルや塩として動植物界に広く存在する。とくに,飽和および不飽和高級脂肪酸はグリセリンエステルの形で油脂中に存在し,高級一価アルコールとのエステルは蠟として存在する。
性質
低級脂肪酸は無色の液体で酢酸に似た刺激臭をもつが,炭素数6前後の中級脂肪酸は不快な腐敗臭をもつ液体である。高級脂肪酸やジカルボン酸,芳香族カルボン酸は固体で,ほとんど無臭である。炭素数3以下のカルボン酸は水によく溶けるが,炭素数が大きくなるにつれて溶解度は低くなる。水溶液は弱い酸性を示し,脂肪酸は一般にpKa=4.2~4.9,芳香族カルボン酸はpKa=4.0~4.2で少し酸性が強い。しかし,カルボキシル基の近くに電子吸引性基がつくと酸として強くなる。たとえば,トリクロロ酢酸(pKa=0.65),トリフルオロ酢酸(pKa=0.30)は無機酸に近い強酸性を示す。脂肪酸は無極性の溶媒中では下記のような水素結合による二量体として存在している。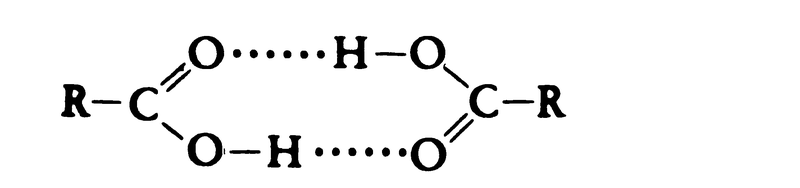
カルボン酸は無機酸と同様にアルカリで中和されて金属塩をつくる。カルボン酸のアルカリ金属塩は水に可溶である。このためカルボン酸は炭酸水素ナトリウムの水溶液によく溶ける。また,アルコールやフェノールとの脱水縮合反応によりエステルをつくる。五塩化リンPCl5や塩化チオニルSOCl2の作用により反応性の高い酸塩化物RCOClをつくり,アシル化剤として有機合成に用いられている。また,五酸化リンP2O5などの脱水剤の作用で酸無水物(RCO)2Oを生じる。
製法・用途
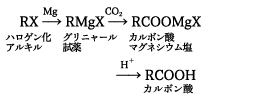
カルボン酸の合成方法としては,油脂などの天然に産出するエステルの加水分解,ニトリルの加水分解,第一アルコールやアルデヒドの酸化等があり,芳香族カルボン酸は側鎖の酸化(トルエンからの安息香酸の合成)や芳香環の部分的酸化開裂(ナフタリンからのフタル酸の合成)などの方法で合成される。実験室的合成法としては,グリニャール試薬に二酸化炭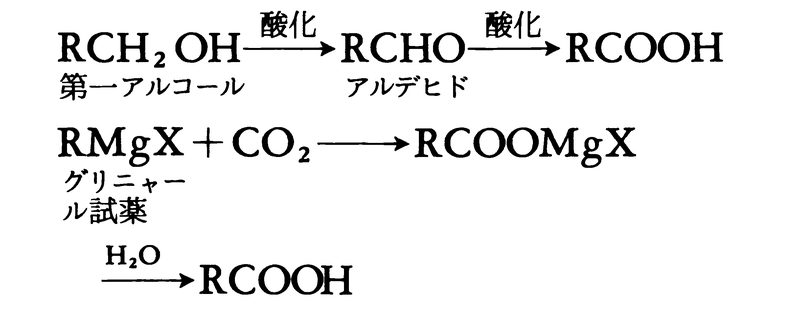
素を反応させ,生成物を希酸で処理する方法もよく用いられている。ほとんどのカルボン酸は有機合成の原料として用いられているが,ギ酸や酢酸のような低級カルボン酸は溶剤としての用途が大きい。また,エステルの形で香料に利用されたり,可塑剤に使われるものも多い。動植物の体内でカルボン酸の果たす役割は大きい。
執筆者:井畑 敏一
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「カルボン酸」の解説
カルボン酸
カルボンサン
carboxylic acid
カルボキシル基-COOHをもつ有機化合物の総称.1分子中にあるカルボキシル基の数により,モノカルボン酸,ジカルボン酸などとよぶ.また,カルボキシル基の結合する炭化水素基によって,飽和,不飽和,脂肪族,芳香族などの別がある.鎖式モノカルボン酸は脂肪酸とよばれる.脂肪酸の高級のものはグリセリドとして生体内に広く分布して脂質を構成し,また高級一価アルコールとエステルは,ろうとして産生する.脂環式および芳香族カルボン酸にも天然に存在するものが多い.カルボン酸の一般的合成法には,次のようなものがある.
(1)第一級アルコールまたはアルデヒドの酸化.二重結合をもつ化合物は,酸化により二重結合のところで炭素鎖が切れてカルボン酸となる.
(2)ニトリルを加水分解する.
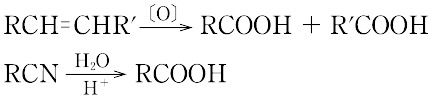
(3)グリニャール試薬あるいは有機リチウム化合物に二酸化炭素を通したのち,酸で処理する.
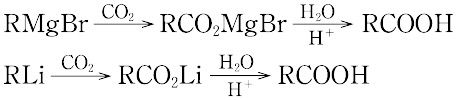
(4)芳香族カルボン酸は,側鎖をもつ芳香族炭化水素を酸化する.
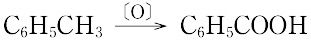
カルボン酸は一般に弱酸で,pKa 4.0~4.9.炭素数3以下の酸は水に溶けるが,炭素数5以上の酸はほとんど水に溶けない.IRスペクトルでは,単量体は1760 cm-1 に,二量体では1710 cm-1 付近に強い吸収を示す.アルコールと反応してエステル,塩化チオニルと反応して酸塩化物,五酸化リンで脱水して酸無水物などの誘導体をそれぞれ生成する.カルボン酸は酸化還元に対して安定であるが,水素化リチウムアルミニウムのような強い還元剤を作用させると第一級アルコールになる.加熱により脱炭酸が起こって炭化水素を与える場合がある.一般には,ソーダ石灰が触媒となる.
RCOOH → RH + CO2
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「カルボン酸」の意味・わかりやすい解説
カルボン酸【カルボンさん】
→関連項目カルボキシル基|ケン(鹸)化|工業用セッケン(石鹸)|石炭化学
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「カルボン酸」の意味・わかりやすい解説
カルボン酸
カルボンさん
carboxylic acid
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
栄養・生化学辞典 「カルボン酸」の解説
カルボン酸
世界大百科事典(旧版)内のカルボン酸の言及
【水素酸】より
…これに対して,硫酸H2SO4,硝酸HNO3,リン酸H3PO4,クロム酸H2CrO4などのような酸素を含む酸はオキソ酸(以前は酸素酸といった)という。またカルボキシル基,水酸基を有する有機酸,たとえば酢酸CH3COOH,酒石酸(CHOH)2(COOH)2などはカルボン酸と呼び水素酸とはいわない。【水町 邦彦】。…
※「カルボン酸」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...