精選版 日本国語大辞典 「二酸化炭素」の意味・読み・例文・類語
にさんか‐たんそニサンクヮ‥【二酸化炭素】
日本大百科全書(ニッポニカ) 「二酸化炭素」の意味・わかりやすい解説
二酸化炭素
にさんかたんそ
carbon dioxide
炭素とその化合物の完全燃焼、生物の呼吸や発酵の際などに生じる気体。俗称炭酸ガス、無水炭酸。炭の燃焼で生じる気体と発酵で生じる気体が同じ物質であることを認め、gas sylvestreとしたのはベルギーのファン・ヘルモントであるが、その化学的性質を詳細に調べたのはイギリスのJ・ブラックである。ブラックは、二酸化炭素は大気中あるいは人間の呼気中に含まれ、石灰水に吸収されると白濁を生じること、カ性アルカリを固定して温和アルカリとすることなどを明らかにして、二酸化炭素を固定空気fixed airとよんだ。ブラックの研究は、化学的性質の違う気体の存在を認める、いわゆる気体化学の時代(18世紀なかばから約50年間)の端緒となった。二酸化炭素は大気中容積で約0.03%含まれ、動物の呼気、発酵などでも生成し、また炭素を含む物質の燃焼、あるいは時に火山の噴気などに含まれる。液化したものは液化炭酸とよばれ、ボンベ詰め(ボンベの色は緑)として市販されている。固体二酸化炭素は固体炭酸またはドライアイス(商品名)とよばれ市販されている。
[守永健一・中原勝儼]
製法
実験室ではキップの装置を用い、炭酸カルシウム(大理石)と希塩酸から発生させる。
CaCO3+2HCl→CaCl2+H2O+CO2
発生気体に含まれる微量の酸は炭酸水素カリウム水溶液を通して除き、濃硫酸を通して乾燥すると純粋なものが得られる。炭酸水素ナトリウムまたは炭酸マグネシウムを熱分解する方法もある。
2NaHCO3→Na2CO3+H2O+CO2
工業的には、石炭、コークスをガス化する際、石灰石CaCO3を焼いて生石灰CaOを製造するときや、アルコール発酵の際の副産物、天然ガス、石油生成の副生ガス、アンモニア合成工程の副生ガスとして多量に得られる。精製には、炭酸ナトリウムまたはエタノールアミン冷水溶液を用い、これに吸収させてから熱分解してもとへ戻す方法が普通用いられる。精製した気体は鋼鉄製のボンベ内に60気圧で液体(液体炭酸)として蓄えられる。
[守永健一・中原勝儼]
性質
無色、無臭、不燃性の気体で空気より重い。空気中に約2.5%含まれると、ろうそくに点火することができない。3~4%含まれると人間は活動能力を失い、20~25%になると仮死状態となるが、元来一酸化炭素と違って有毒ではない。液化しやすく、常温でも50気圧にすると液化する。液体二酸化炭素は常温では加圧下でなければ安定に存在することができず、ボンベの口にズックの袋をかぶせてボンベから液体炭酸を空気中に吹き出させると盛んに蒸発し、その際蒸発熱を吸収して周囲の温度が下がり、液体炭酸の一部が固化し、袋の中には雪のような固体炭酸ができる。これを型に入れて固めたものがドライアイスである。
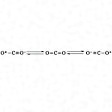
気体、液体、固体中でつねに分子の存在が認められる。分子は直線形O-C-Oで、C-O距離は1.16Å(Åはオングストローム、10-10メートル)。この距離は普通の炭素‐酸素二重結合に対して期待される値1.22Åよりもかなり短い(二酸化炭素の共鳴構造の参照)。二酸化炭素は非常に安定な化合物で、2000℃で2%ぐらい一酸化炭素と酸素に解離するにすぎない。熱した炭素、亜鉛、鉄などの上を通すと一酸化炭素に還元される。マグネシウムやアルカリ金属は、二酸化炭素中で加熱すると燃えて炭素を遊離する。アルカリ金属やアルカリ土類金属の水酸化物と炭酸塩をつくる。水酸化カルシウムでは、いったん沈殿した炭酸塩CaCO3が過剰の二酸化炭素とさらに反応して可溶性の炭酸水素塩Ca(HCO3)2を生じる。この石灰水との反応は二酸化炭素の検出法に用いられる。また、自然界における石灰石の溶出や沈降(鍾乳(しょうにゅう)洞、石筍(せきじゅん)など)はこの反応による。他の気体に比べて二酸化炭素は水に溶けやすく、室温1気圧で約0.03モル溶液となる。水溶液中には炭酸を生じており(ただし大部分は水分子とゆるく結合しているだけであって炭酸を生成してはいない)、pH約4の酸性を示す。高温高圧下でアンモニアと二酸化炭素を反応させると、中間にカルバミン酸アンモニウムH2NCO2NH4を生じて次のように反応が進む。
2NH3+CO2→H2N・CO2・NH4
H2NCO2NH4→H2NCONH2+H2O
この反応は尿素H2N・CO・NH2(肥料)の製造に用いられる。
[守永健一・中原勝儼]
用途
もっとも重要な用途は、炭酸ナトリウム、炭酸水素ナトリウム(重曹)、鉛白(塩基性炭酸鉛)の製造ならびにソーダ水などの清涼飲料水用である。液体炭酸は消火剤に用いられる。固体炭酸は優れた冷凍剤で、食料品、果物などの貯蔵、輸送に適している。
[守永健一・中原勝儼]
薬用
呼吸興奮薬の一種。二酸化炭素は呼吸中枢を刺激して吸気作用をおこさせる働きをもつ。動脈血中の二酸化炭素の量が減少すると、呼吸数が減じ、末梢(まっしょう)血管の拡張がおこって、血圧低下、心拍数の増加と血液拍出量の減少がみられる。もともと二酸化炭素は呼気より排出される生体の代謝産物であるが、これが動脈血中に増加すると、呼吸中枢が興奮して呼吸が速くなり、ガス交換を盛んにして血中の二酸化炭素の量を少なくしようとする。また、空気中の二酸化炭素の濃度が3~5%になると生理的影響が現れ、8%を超えると呼吸困難を訴え、10%以上になると意識喪失がみられ、18%で致命的となる。
なお、呼気中には二酸化炭素が約4.4%含まれており、過換気症候群の発作時には数リットル程度の大きさの紙袋で口と鼻を覆って呼吸し、呼気中の二酸化炭素を再吸入することによって発作を消失させる。また一般に酸素吸入を行うときには、酸素単独よりも二酸化炭素を5~10%混ぜて用いたほうが有効である。このほか、固形炭酸(ドライアイス)は皮膚疾患の腐食剤として使われている。
[幸保文治]
『井上祥平・泉井桂・田中晃二編『二酸化炭素――化学・生化学・環境』(1994・東京化学同人)』▽『大前巌著『二酸化炭素と地球環境』(中公新書)』
二酸化炭素(データノート)
にさんかたんそでーたのーと
二酸化炭素
CO2
式量 44.0
融点 (昇華)
沸点 -
比重 1.529(空気=1)
(密度) 1.976g/L(0℃,1気圧)
結晶系 立方
屈折率 (n)1.000449
昇華点 -78.5℃(1気圧)
三重点 -56.6℃(5.2気圧)
臨界温度 31.0℃
臨界圧 72.8気圧
蒸発熱 56cal/g(0℃)
改訂新版 世界大百科事典 「二酸化炭素」の意味・わかりやすい解説
二酸化炭素 (にさんかたんそ)
carbon dioxide
化学式CO2。俗称炭酸ガス。地球をはじめ多くの惑星の大気中に存在し,地球上では大気中に体積で約0.03%程度含まれる。炭素を含む物質の燃焼,動植物の呼吸や代謝,発酵,火山の噴火などによりつねに生成されており,一方,植物の炭酸同化作用により消費されている。近年は化石燃料,とくに石油の消費量の増加に伴い,大気中の二酸化炭素の含有量が増加しているといわれている。海水中には炭酸塩または炭酸水素塩として含まれ,また炭酸塩鉱物の構成成分となっている。実験室では,石灰石に塩酸を作用させて気体として捕集する。また工業的には石灰石を加熱分解して得るが,石炭の燃焼やアルコール発酵の際に生ずる二酸化炭素も利用される。いったん生成した二酸化炭素を炭酸ナトリウムやエチルアルコールアミンの水溶液に吸収させ,得られる炭酸水素塩やエチルアンモニウム炭酸塩を熱分解して純度の高い二酸化炭素を得ることができる。O-C-Oの直線型分子で,C-O間結合距離は1.160Åで,O⁺-C≡O⁻⇄O=C=O⇄O⁻≡C-O⁺の共鳴構造をとっている。
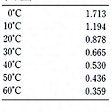
無色無臭の気体。不燃性で,わずかに酸味がある。密度は1.976g/l(0℃,1気圧)で,空気の1.53倍。固体の二酸化炭素は常圧下では融解せずに昇華する。昇華点-78.5℃(1気圧),三重点-56.6℃(5.2気圧)。臨界温度31.0℃,臨界圧72.80気圧。1lの水には1.71l(0℃)~0.44l(50℃)程度溶ける。水に溶けると一部分はCO2分子状で,また他の一部は炭酸H2CO3となり,解離して酸性を示す。エーテル,ベンゼンなどには溶けるが,多くの有機溶媒には不溶。液体の二酸化炭素はいくらか水を溶かす(-29℃で約0.02%,22℃で約0.1%程度)が,塩類はほとんど溶かさない。2000℃までは安定であるが,さらに高温になると一酸化炭素と酸素とに解離する。水素とは可逆的に反応して一酸化炭素と水を生ずる。適当な触媒を用いて水素と反応させるとメタン,ギ酸,メチルアルコールなどを生ずる。アルカリ金属,アルカリ土類金属と加熱すると炭素に還元され,また水分があるとギ酸塩を生ずる。多くの金属酸化物や水酸化物と反応して炭酸塩を生ずるが,過剰の二酸化炭素により炭酸水素塩になることがある。ことにカルシウムイオンとの反応は代表的で,二酸化炭素の分圧により,水に不溶の炭酸塩と,水に可溶の炭酸水素塩とが可逆的に生成する。鍾乳洞の鍾乳石や石筍(せきじゆん)の生成はこの反応による。工業的には清涼飲料水の製造,アンモニアソーダ法による炭酸ナトリウムの製造,アンモニアとの直接合成法による尿素の製造に用いられ,また固体の二酸化炭素はドライアイスとして冷却剤に用いられる。二酸化炭素そのものには毒性はないが,呼吸作用には役立たないため,空気中の含有量が10%以上になると,相対的に酸素分圧が低下し,人間は呼吸困難となり仮死,窒息する。
執筆者:大瀧 仁志
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
化学辞典 第2版 「二酸化炭素」の解説
二酸化炭素
ニサンカタンソ
carbon dioxide
CO2(44.01).炭酸ガスともいう.多くの惑星の大気中に存在する.地球上では空気中に体積で約0.03% 含まれているほか,鉱泉水,天然ガスなどにも含まれ,炭素を含む物質の燃焼,火山の噴火などによって絶えず生成されている.実験室では,石灰石に塩酸を作用させて発生させる.工業的には石灰石を加熱分解してつくる.石炭などを燃やしたときや,エタノール発酵などの発酵のときに発生する二酸化炭素も利用されている.O-C-Oの直線形分子でC-O0.162 nm.無色,無臭,不燃性の気体で支燃性もない.空気中で10% 以上の濃度になると人間は呼吸困難になって意識を失う.空気を1としたとき,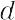 1.529.密度1.976 g L-1(0 ℃,1 atm).固体二酸化炭素は常圧では昇華する.昇華点-78.5 ℃(1 atm),融点-56.5 ℃(5.2 atm).臨界温度31.0 ℃.臨界圧72.80 atm.1 atm で100 mL の水に対する溶解度は171 mL(0 ℃),119 mL(10 ℃),88 mL(20 ℃).水溶液中では炭酸を生じ,わずかに酸性を示す.
1.529.密度1.976 g L-1(0 ℃,1 atm).固体二酸化炭素は常圧では昇華する.昇華点-78.5 ℃(1 atm),融点-56.5 ℃(5.2 atm).臨界温度31.0 ℃.臨界圧72.80 atm.1 atm で100 mL の水に対する溶解度は171 mL(0 ℃),119 mL(10 ℃),88 mL(20 ℃).水溶液中では炭酸を生じ,わずかに酸性を示す.
H2CO3 H+ + HCO3-
H+ + HCO3-
pKa 6.35.エタノール,脂肪族カルボン酸中へは水よりもよく溶ける.エーテル,ベンゼンとは混和するが,ほかの多くの有機溶媒とは混和しない.2000 ℃ までは安定であるが,さらに高温では一酸化炭素と酸素に解離する.水素とは可逆的に反応して,一酸化炭素と水とを生じる.アルカリ金属,アルカリ土類金属と加熱すると,炭素やギ酸塩に還元される.多くの金属の酸化物,水酸化物と反応して炭酸塩を生じる.とくに水酸化カルシウム水溶液では,はじめ炭酸塩を沈殿するが,長く通じると炭酸水素塩を生じて溶解する.しょう乳洞,しょう乳石,石じゅんの生成はこの反応による.清涼飲料の製造,可燃性物質の製造・取り扱い時の不活性化用,エーロゾルなどに用いられる.化学工業では炭酸塩の製造に用いられる.固体二酸化炭素はドライアイスとよばれ,冷凍食品工業,その他で寒剤として利用されている.[CAS 124-38-9]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア 「二酸化炭素」の意味・わかりやすい解説
二酸化炭素【にさんかたんそ】
→関連項目環境税|地球温暖化|地球温暖化防止条約|フロン代替材料
出典 株式会社平凡社百科事典マイペディアについて 情報
ブリタニカ国際大百科事典 小項目事典 「二酸化炭素」の意味・わかりやすい解説
二酸化炭素
にさんかたんそ
carbon dioxide
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
最新 地学事典 「二酸化炭素」の解説
にさんかたんそ
二酸化炭素
carbon dioxide
不燃性ガスの一種。炭酸ガスとも。分子式はCO2。天然のものは,無機起因ガスと有機起因ガスに区分。無機起因二酸化炭素は大部分が火山性であるが,炭酸塩鉱物に由来する例もある。有機起因二酸化炭素は炭化水素に伴う例が多く,特に第四系中の水溶性天然ガスに多い。製鉄業やドライアイス製造など用途は広い。
執筆者:木下 浩二
出典 平凡社「最新 地学事典」最新 地学事典について 情報
栄養・生化学辞典 「二酸化炭素」の解説
二酸化炭素
世界大百科事典(旧版)内の二酸化炭素の言及
【植生】より
…およそ45億年といわれる地球の歴史の半ばの20億年ころに,植物の働きで大気中に増加したと考えられている酸素は,現在では大気の容量で20.95%を占め,全生物が1年間に大気と交換する量の1万倍程度存在しており,植生の影響による増減はあまり問題にならない。一方,植物の炭素源となる二酸化炭素は大気中に容量で0.035%しかなく,炭素量にすれば約7000億tで,全地球の植物体に現存している炭素総量とほぼ等しい。これは,もし動物や微生物による大気への二酸化炭素の還元がないとすれば,15年程度で陸上植物により利用されつくす量にすぎないので,大気中の二酸化炭素量は植生の影響を強く受ける。…
【ドライアイス】より
…固体の二酸化炭素CO2の俗称。気体の二酸化炭素を圧縮液化し,ノズルから噴出させると,断熱気化の際の潜熱により冷却され,その一部が雪状の粉末となる。…
※「二酸化炭素」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...