有機電子論
ゆうきでんしろん
electron theory (in organic chemistry)
有機化合物の性質と有機化学反応を、化合物を構成している電子の挙動により理解しようとする理論。有機電子説ともいう。イギリスのR・ロビンソン、インゴルドらを中心として展開された理論で、アメリカのポーリングによる共鳴理論の影響を強く受けている。
有機電子論においては、有機分子を構成する化学結合をσ(シグマ)結合とπ(パイ)結合に区別して、これらの結合に属する電子をそれぞれσ電子とπ電子に分けて論じる。そのうえで、有機分子中の電子の反応挙動を、分子が反応に関与せず孤立して存在している静的状態と、他の分子と相互作用をしている(反応に関与している)動的状態に分けて取り扱う。
有機分子中の電子の変位により分子中の電子分布は均等でなくなり、電子が多く集まる原子は負電荷をもち、電子が希薄になる原子は正電荷をもつようになる。この現象を分極とよんでいる。有機電子論では、結合(や分子)の分極を、(1)原子の電気陰性度の差により生じる価電子全体に対する静的誘導効果(誘起効果、I効果ともいう)による分極、(2)π電子に特有な共鳴効果(メソメリー効果、M効果ともいう)により引き起こされる静的分極、(3)反応の際に分子に一時的に生ずる分極率による動的分極に分けて評価する(表)。I効果は、結合をつくっている両原子の電気陰性度の差に起因して生ずる分極で、電気陰性度が大きいほうの原子が負電荷をもち、電気陰性度が小さいほうの原子が正電荷をもつように分極する。M効果は、分極に対するπ電子の寄与分であり、限界構造式(共鳴構造式)を書いて、そのうちで分極した限界構造式での正負の電荷の分布から評価される。I効果とM効果を重ね合わせると、その分子の静的な電子的性質がわかる。
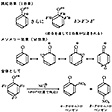
以下に、クロロベンゼンを例として、有機電子論の応用について説明しよう。塩素のほうが炭素に比べて電気陰性度が大きいので、I効果によりC-Cl結合は塩素が負になり炭素が正になるように分極している。この分極では電子が部分的に塩素側に偏って存在するだけで、完全に塩素が陰イオン、炭素が陽イオンになっているわけではないので、δ(デルタ)をつけてCδ+-Clδ-のように表す(δは1よりも小さい)。これとは別に、塩素原子の非共有電子対(つい)である2p電子とベンゼン環のπ電子との共鳴(メソメリー)により、逆に塩素原子からベンゼン環のオルトとパラの位置に電子が移動するM効果がおこっている。クロロベンゼンの性質はI効果とM効果をあわせたものとしてよく説明できる。
いままで静的分極について説明してきたが、実際に有機化学反応を考える場合には、有機分子と他の分子(試薬)との相互作用を考慮に入れなければならなくなる。反応の際に他の電荷をもった試薬分子が接近することにより引き起こされる分極を動的分極といい、動的分極の大きさは分極率によって決まってくる。
有機分子に対して求電子試薬(陽イオン)や求核試薬(陰イオン)が攻撃する芳香族置換反応は、これまで述べた分極により説明できる。クロロベンゼンのニトロ化の例では、ニトロニウムイオンNO2+によるπ電子系への求電子的攻撃により反応が進行するので、M効果により負の電荷を帯びているオルトとパラの位置におこると予測されるが、実際にもクロロニトロベンゼンのオルトおよびパラ異性体が得られている(図)。
有機電子論は、種々の有機反応を価電子の動きにより理解するのに便利であるので、広く応用されてきたが、議論が定性的であるという欠点をもっている。現在では、有機電子論にかわり、分子軌道法を基礎とした新しい電子理論が有機反応の解明に応用されている。
[廣田 穰 2016年11月18日]
『井本稔著『有機電子論解説――有機化学の基礎』第4版(1990・東京化学同人)』▽『右田俊彦編著、西山幸三郎著、一国雅巳・井上祥平・岩沢康裕・大橋裕二・杉森彰・渡辺啓編『有機化学の考え方――有機電子論』(1997・裳華房)』
出典 小学館 日本大百科全書(ニッポニカ)日本大百科全書(ニッポニカ)について 情報 | 凡例
Sponserd by 
有機電子論 (ゆうきでんしろん)
electronic theory of organic chemistry
有機化合物の反応性や有機化学反応の経路を電子の状態や移動から説明する理論。単に電子論あるいは電子説ともいう。具体的には20世紀前半のイギリスの化学者ラップワースA.Lapworth,ロビンソンRobert Robinson(1886-1975),インゴルドChristopher Kelk Ingold(1893-1970)らの理論をいう。彼らの主張の多くは現在の定性的な有機化学反応論の基礎をなしており,彼らの用語も今なお用いられている。彼らは有機化学をイオン反応とラジカル反応に大別し,イオン反応には純粋なイオン(カチオン=陽イオンとアニオン=陰イオン)だけではなく,分極によって生じた電子不足性の部分をもつカチオノイド,電子過剰性の部分をもつアニオノイド(ロビンソンの用語)も関与すると考えた。インゴルドはこれらをそれぞれ求電子試薬,求核試薬と命名した。置換基が分子の反応性に及ぼす効果も有機電子論によって説明された。ロビンソンは置換基効果を誘起(I)効果とエレクトロメリー(M)効果に分類したが,インゴルドはこれらをさらに細かく分類した。
有機電子論は定性的・経験的手法ではあるが,複雑な有機化学反応を整理し,反応性の定性的な目安を与えたことによって,有機化学の発展に計り知れない貢献があった。20世紀後半になってウィーラントGeorge Willard Wheland(1907-72)は共鳴理論を,デュワーMichael James Steuart Dewar(1918-97)は分子軌道法をそれぞれ有機電子論に応用した。一方,1930年代にアメリカのハメットLouis Plack Hammett(1894-1987)が見いだした,ベンゼンの誘導体における置換基効果の加成性(ハメット則)は,その後,直線自由エネルギー関係(LFER)と呼ばれる方法論に発展し,より広い範囲の化合物,現象に適用できるようになった。こうして,有機電子論を量子力学的取扱いで完全に再現することはまだできないにしても,少なくとも基本的には説明可能であることが示された。今日では有機電子論は,分子軌道法に基礎をおいた理論有機化学,量子有機化学に発展したとみることができるが,今なお多くの複雑な反応の定性的な解析は有機電子論のレベルと用語でまず行われ,必要に応じて量子力学的な定量化を受けるのが実情である。
執筆者:竹内 敬人
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
Sponserd by 
有機電子論【ゆうきでんしろん】
有機化合物の性質,特に反応性を有機化合物の電子構造から説明する理論。歴史的には1920年代から1930年ころR.ロビンソン,インゴルドらによって始められ,多くの実験事実に基づき発展。その後量子化学の発展によって理論的基礎づけがなされた。有機電子論の対象となる反応は主としてイオン反応であるが,イオン反応が求核的反応と求電子的反応に分類され,それぞれに対応して電子供与性の基と電子受容性の基の影響が統一的に説明される。
→関連項目有機化学
出典 株式会社平凡社百科事典マイペディアについて 情報
Sponserd by 
有機電子論
ゆうきでんしろん
organic electron theory
有機化合物の構造,性質,反応を,その分子を形成している原子の,主として外殻電子の挙動によって解明しようとする理論。古い有機化学はいわば記述的学問体系であったが,これによって理論的に解明されるようになってきた。有機反応論とともに R.ロビンソン,C.インゴールド,L.ポーリングらによって 1920年代中頃に始り,特に 30年代中頃から 50年代に急速に発展した。有機電子論では,結合や反応に関係する電子の挙動を誘起効果,エレクトロメリー効果,共鳴効果および立体効果によって説明している。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
Sponserd by 
世界大百科事典(旧版)内の有機電子論の言及
【化学】より
…シクロヘキサン環の形や反応性のように単結合のまわりの回転で決まる構造や性質の研究は配座解析と呼ばれるようになった。有機化合物の示す多様な反応性と反応の方向を結合および試薬の極性で説明する有機電子論が,R.ロビンソン,ヒュース,インゴルドChristopher Kelk Ingold(1893‐1970)らによって確立された。彼らによると,結合の分極が反応の原動力となるイオン反応は求核反応と求電子反応に,各反応はさらに律速反応の型に従って一次反応,二次反応に分類された。…
※「有機電子論」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
Sponserd by