関連語
共同通信ニュース用語解説 「骨髄異形成症候群」の解説
骨髄異形成症候群
赤血球や白血球などの血液細胞のもとになる骨髄の造血幹細胞が侵され、正常な血液細胞がつくれなくなる血液がんの一種。貧血や疲労感、感染症にかかりやすいといった症状が出る。重症例に骨髄移植が行われる。
更新日:
出典 共同通信社 共同通信ニュース用語解説共同通信ニュース用語解説について 情報
内科学 第10版 「骨髄異形成症候群」の解説
骨髄異形成症候群(造血不全)
定義・概念
骨髄異形成症候群(MDS)は多能性造血幹細胞の形質転換で生じたクローン性の造血障害で,血液系細胞の形態系細胞の異形成と骨髄での無効造血を特徴とする.臨床的には1~3系統の血球減少,骨髄もしくは末梢血の芽球比率が急性骨髄性白血病(acute myelogenous leukemia:AML)より高くない疾患群で,AMLへの移行のリスクが高い特徴をもつ.
分類
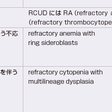
従来FAB分類およびWHO分類が用いられていたが,2008年には改変WHO分類が報告された.2008年WHO分類では①異形成の頻度が10%未満のものはidiopathic cytopenia of undetermined significance(ICUS)としてMDSより分離させたこと,②RCMD-RSをRCMDと一括したこと,③RAの名称をRCUD(refractory cytopenia with unilineage dysplasia)の1病型として,RCUDにRA(refractory anemia),RN(refractory neutropenia),RT(refractory thrombocytopenia)として分類すること,④MDS-U (MDS-unclassified)を比較的詳細に規定していることが大きな変更点である(表14-9-8).
疫学
MDSの有病率は10万人あたり2.7人で欧米との差は顕著でなくしだいに増加傾向にある.わが国でのMDS発症年齢の中央値は64歳で,欧米に比べ10歳ほど発症年齢は若い.男女比は1.9:1と男性に多くみられる.
病態生理
1)治療関連骨髄異形成症候群:
MDSには原因が不明なものと,放射線・アルキル化薬やトポイソメラーゼⅡ阻害薬などの抗腫瘍薬投与後に発症するもの(治療関連MDS)がある.WHO分類では治療に起因するMDSは治療関連AML/MDSとして一括してAMLの中に分類されている.前治療の薬剤により特徴的な染色体異常や臨床経過が知られ,アルキル化薬関連AML/MDSとトポイソメラーゼⅡ阻害薬関連AML/MDSに分類される.
2)染色体異常と遺伝子異常:
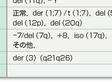
MDSの半数に染色体異常がみられ,予後との関係が知られている(表14-9-9).遺伝子異常として受容体型チロシンキナーゼ遺伝子FLT3(MDSの2〜5%),RAS癌遺伝子(MDSの10〜15%),転写制御因子遺伝子AML1(MDSの10〜15%),p53癌抑制遺伝子異常(MDSの5〜10%)がみられるが,AMLとは異なる遺伝子異常を背景にもつと考えられる(表14-9-10).
近年,DNAメチル化の研究が進められ,MDS患者ではDNAやヒストンのメチル化に関与する遺伝子の変異が知られ,脱メチル化薬による治療反応性との関係が検討されている.代表的な変異としてはシトシン残基の5位の部位に生じたメチル基をヒドロキシメチル基に置き換えるときに働くTET2遺伝子の変異やTET2のコファクターとして働く2-hydroxyglutarateの産生を阻害するIDH1/2の変異が知られ,MDSの進展に重要な意義をもつことが報告されている.さらに多くのRARS(refractory anemia with ringed sideroblasts,環状鉄芽球を伴う不応性貧血)ではRNAスプライシング関連蛋白であるSF3B1の遺伝子変異が知られ,注目を集めている.
3)MDS芽球:
芽球の性状はCD34+CD38+HLA-DR+CD13+CD33+である一方,ミエロペルオキダーゼは過半数例が陰性であることよりAMLの芽球よりも幼若な段階にあることが推定されている.
臨床症状
一般に発症時は臨床症状に乏しいことも少なくない.血球減少の程度により貧血症状,出血傾向,感染症の合併がみられるが,臓器腫大はほとんどの例でみられない.
検査成績
1)末梢血:
貧血(正球性あるいは大球性貧血)を中心とする汎血球減少がみられる.RARSではまれに血小板増加がみられることもある(RARS with thrombocytosis:RARS-T).
2)骨髄:
正形成~過形成を原則とするが,10%程度の症例では低形成髄で再生不良性貧血との鑑別が問題となるため,骨髄MRIや骨髄シンチグラフィが必要な場合もある.
MDSの診断ではdysplasiaとよばれる血球の形態異常の存在が重要であるが(図14-9-9),巨赤芽球性貧血や抗悪性腫瘍薬投与後,骨髄増殖性腫瘍などでもみられる変化のためほかの要因を十分に考慮する.WHO分類では当該血球系列の10%以上の異形成所見を有意と定義している.鉄芽球性貧血(RARSおよびRCRS)では特徴的な環状鉄芽球がみられる. また,無効造血として血清鉄の上昇,血清フェリチンの高値,LDHの上昇,エリスロポエチンの上昇がみられる.
診断
血球減少をみた場合,MDSを念頭におき除外診断を進める.二次性貧血の除外が重要で,骨髄塗抹標本での形態異常を中心に診断を下す.骨髄染色体検査も重要で約半数の患者では染色体異常が確認でき診断根拠となるが,染色体異常がなく形態診断のみとなることも多く,経過を追っての血球減少の確認および骨髄検査が必要なことも多い.また異形成像が軽微なものや,境界領域との鑑別を要するものも存在することを忘れてはいけない.
鑑別診断
血球減少をきたすすべてのものとの鑑別診断が必要であるが,造血細胞の異形成がみられる場合が特に問題となる.芽球頻度が低く異形成のみられるものとして悪性リンパ腫などで遭遇するサイトカインストームによる異形成が代表的なものである.
境界領域との鑑別として再生不良性貧血があげられるが,オーバーラップする病態も知られていることより必ずしも明確な区別ができない症例も存在する.また,再生不良性貧血に対する免疫抑制療法後にみられるMDSもある(治療後の7%程度,7モノソミーを示すことが多い).WHO-2008分類ではICUSを設け,MDSと再生不良性貧血の中間的な存在として位置付けている.
MDSとAMLの境界は骨髄での芽球比率20%であり,造血細胞に異形成がみられるもので,芽球が20%以上のものはAML with dysplasiaとして分類される. 骨髄増殖性疾患の要素が大きい場合は骨髄異形成/骨髄増殖性腫瘍(MDS/MPN)の診断となるため,骨髄異形成と血球増加のみられる場合には,注意して鑑別することが必要である.
合併症
進展様式としては約1/3にAMLへの移行がある.MDSそのものの合併症として好中球減少に基づく細菌感染症や真菌感染症がある.特に芽球の多い症例での化学療法による寛解導入療法期に注意する必要がある.血小板減少による出血,支持療法としての低リスクMDS患者における輸血療法に伴ってみられる二次性ヘモクロマトーシスの管理も重要である.芽球頻度の少ない症例や化学療法施行例では顆粒球コロニー刺激因子(G-CSF)の投与が行われるが,MDSに伴ってみられるSweet病(病的好中球の皮膚浸潤)はG-CSF投与により悪化する.呼吸器の合併症としてまれに閉塞性細気管支炎(bronchiolitis obliterans:BO)がみられ,呼吸器感染症との鑑別が必要である.
予後
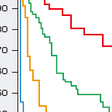
予後を決定する因子として,IPSS(international prognostic scoring system)による予後スコアリングシステムが用いられる.IPSSでは末梢血液の血球減少(なし・1血球系統のみ・2血球系統・汎血球減少),骨髄での芽球比率(<5%・5〜10%・11〜20%・20%以上[ただしFAB分類を用いた場合]),染色体異常(良好核型・中間核型・不良核型)により点数をつけ50%生存期間および白血病移行率を割り出す(図14-9-10,表14-9-11).現在,詳細な染色体異常に基づく予後判定が提案されており,個々の症例における予後判定がさらに明瞭化されつつある(表14-9-12).予後を決定する因子は急性白血病への移行,感染症・出血であるとともに,年齢の要素が大きくかかわってくる.
治療
治療方針として,低リスク群では輸血依存からの離脱,高リスク群では白血病移行の阻止を目的とするが,基本的には同種造血幹細胞移植が根本的な治療法である.
1)低リスク群MDS(IPSSでlowおよびint-1):
この群に含まれる患者はFAB分類でRAとRARSの大多数に相当し,血球減少への対応が主となる.症状を有する貧血に対しては赤血球輸血で対応するが,輸血による鉄過剰症は肝臓・心臓など重要臓器の障害をきたすため,鉄キレート剤が併用される.出血症状に対しては血小板輸血を行うが,反復する輸血による同種抗体の産生を防ぐため,高度の血小板減少を認める患者以外では予防的血小板輸血を行わない.感染症併発時には十分量の抗菌薬とともにG-CSFの併用が勧められる.
輸血依存の例(70歳未満)の患者にはシクロスポリンの経口投与や抗胸腺細胞グロブリン(ATG)による免疫抑制療法が有効なこともある(有効率50~60%)(保険適応なし).また,エリスロポエチン濃度の比較的低い例(500 mU/mL未満)にはエリスロポエチン投与の有効性も知られている(保険適応なし).immunomodulatory derivertives of thalidomide(IMiDs)としてレナリドミドは5q−異常の患者に有効である(貧血改善率70~80%)が,5q−の欠失部位により有効性は異なることがある.
わが国では副腎皮質ステロイドホルモン,蛋白同化ステロイドが用いられるが,効果は一時的なことが多い.また30%程度の患者ではビタミンK2・ビタミンD3療法で赤血球および血小板の改善が期待できる.
同種造血幹細胞移植はこの群においても治癒を期待できる有望な治療法であり,高度の輸血依存性,繰り返す感染症,IPSSで予後不良染色体,血球形態異常の著しい例および免疫抑制療法によっても造血回復の得られない例で考慮される.
2)高リスク群MDS(IPSSでint-2およびhighの全例):
FAB分類でRAEBの一部とRAEB-Tの大部分に,WHO分類では予後不良染色体をもつRAEB-1,RAEB-2の大部分に相当する.この群は白血病移行が生命予後を左右することから,化学療法と同種造血幹細胞移植が治療選択肢となる.予後不良染色体をもたずFAB分類でRAEB-Tに当たる患者には,AMLに準じた化学療法を行う.
ドナーが存在し同種移植に耐えられる年齢および全身状態であれば,同種造血幹細胞移植が第一選択である.同種造血幹細胞移植の予後不良因子として予後不良染色体異常,骨髄芽球比率が高いこと,診断から移植までの期間が長いこと,ならびに年齢があげられる. 低リスク群における輸血依存からの離脱を含む血液学的改善(有効率50%)および高リスク群における白血病移行の阻止(20%程度の有効性)を期待して,脱メチル化薬による治療法(アザシチジン:75 mg/m2
,7日間)がある.合併する感染症などの回避と治療有効性との関係から最適な治療法は現在模索中である.[大屋敷一馬]
■文献
不応性貧血(骨髄異形成症候群)の診断基準と診療参照ガイド作成のためのワーキンググループ:不応性貧血(骨髄異形成症候群)診療の参照ガイド.臨床血液,47: 47-68,2006.
Vardiman JW, Harris NL, et al: The World Health Organization (WHO) classification of the myeloid neoplasms. Blood, 100: 2292-2302, 2002.
骨髄異形成症候群(造血幹細胞移植の適応の考え方)
a.予後予測因子
MDSの予後予測分類として最も広く用いられてきたのは骨髄中の芽球,染色体分析,血球減少に基づいて分類するinternational prognostic scoring system(IPSS)である.近年,WHO分類,輸血依存性などを時間依存性変数として含めた新しい予後予測(WPSS)が提唱されており,発症以降の経過観察中にも移植適応を判断できるモデルとして期待されている.
b.造血幹細胞移植の適応
移植適応,あるいは移植を行うべき時期については,①診断直後に移植を行う,②AMLに進行したら移植を行う,③診断後ある一定の時点(2,4,6,8年後)で移植を行う,の3つの治療戦略の妥当性について検討された臨床決断分析の結果(Cutlerら,2004),IPSS lowあるいはint-1では,待機的にAMLに進展する直前に移植を行う方が,診断時にすぐに移植を行うよりもより長い生存期間が期待できることが示された.一方,int-2あるいはhighにおいては診断直後に移植を行うことによって,最も長い生存期間が期待できることが示された(図14-8-8).[神田善伸]
■文献
Koreth J, Schlenk R, et al: Allogeneic stem cell transplantation for acute myeloid leukemia in first complete remission: systematic review and meta-analysis of prospective clinical trials. JAMA, 301: 2349-2361, 2009.
Cutler CS, Lee SJ, et al: A decision analysis of allogeneic bone marrow transplantation for the myelodysplastic syndromes: delayed transplantation for low-risk myelodysplasia is associated with improved outcome. Blood, 104: 579-585, 2004.
Oliansky DM, Czuczman M, et al: The role of cytotoxic therapy with hematopoietic stem cell transplantation in the treatment of diffuse large B cell lymphoma: update of the 2001 evidence-based review. Biol Blood Marrow Transplant, 17: 20-47 e30, 2011.
出典 内科学 第10版内科学 第10版について 情報
家庭医学館 「骨髄異形成症候群」の解説
こつずいいけいせいしょうこうぐん【骨髄異形成症候群 Myelodysplastic Syndrome】
以前から治療のむずかしい貧血で、急に白血病(はっけつびょう)(「白血病とは」)に移行するものがあり、不応性貧血(ふおうせいひんけつ)とか、前白血病(ぜんはっけつびょう)とか、くすぶり白血病(はっけつびょう)とかいわれていました。
現在では、これらの病気は血球(けっきゅう)の量や質が異常になる病気として、まとめて骨髄異形成症候群と呼ばれます。
原因はよくわかっていませんが、造血細胞が血球をつくるときに、成熟がうまくいかず、能力のない血球になってしまうためにおこると考えられています。
そのため、赤血球(せっけっきゅう)、白血球(はっけっきゅう)、血小板(けっしょうばん)などが減少し、貧血の一般症状(貧血とはの「貧血の症状」)が現われるほか、感染症になりやすく、出血しやすい傾向がみられます。
50歳以上の男性に多く、慢性に過ごしているうちに白血病化、感染、出血などで亡くなることもあります。
治らない貧血、血球の異常、骨髄組織の異常などを検査しますが、専門医でも診断のむずかしい病気です。
[治療]
この病気を治す方法は、今のところ、骨髄移植(「骨髄移植の知識」)しかありません。
しかし、患者さんが高齢であることが多く、また、骨髄もなるべく適合性のよいものでなければならないなどから、手術ができない、あるいは手術がうまくいかないこともあります。
したがって、白血病化したら急性骨髄性白血病(「急性白血病」)と同様の化学療法が行なわれたり、また、ビタミンなどの薬剤の使用、ステロイド(副腎皮質(ふくじんひしつ)ホルモン)の使用など、症状を抑える治療が行なわれますが、あまり効果があるとはいえません。
輸血は効果的ですが、何回もくり返している間に効果がなくなることがありますので(輸血不応症)、慎重にするべきです。
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...