翻訳|lithium
精選版 日本国語大辞典 「リチウム」の意味・読み・例文・類語
リチウム
改訂新版 世界大百科事典 「リチウム」の意味・わかりやすい解説
リチウム
lithium
周期表第ⅠA族に属するアルカリ金属元素の一つ。1817年スウェーデンのアルフェドソンJohan August Arfwedson(1792-1841)が葉長石petaliteから発見した。同じアルカリ金属のナトリウムやカリウムが動植物界に存在するのに対し鉱物界から見いだされたことにより,ギリシア語のlithos(石)にちなんで命名した。美しい赤色の炎色反応は,18年ドイツのグメリンC.G.Gmelinが初めて観察した。かなりの量の単体を初めて取り出したのは55年ドイツのR.W.E.ブンゼンらで,溶融塩化物の電解によったものである。天然には岩石中に微量であるが広く分布しており,資源鉱物(いずれも含有量数%程度)としては,鱗雲母lepidolite,リシア輝石spodumene,葉長石などのケイ酸塩鉱物,リン酸塩鉱物のアンブリゴ石amblygoniteなどがある。また生物界にも広く見いだされ,タバコ,コーヒー,海藻,牛乳,血液などの中にも微量存在することがわかっている。同位体には核融合の過程で重要な働きをするものが多い。
性質
銀白色の軟らかい金属。ナトリウムより硬く,モース硬度0.6。結晶構造は体心立方格子,格子定数a=3.5017Å(20℃)。気体には二原子分子があり,Li-Li原子間距離2.07Å。固体単体中で最も軽い。比熱0.941cal/K・gで,固体金属中最大。比抵抗8.55×10⁻6Ωcm(0℃)。線膨張率6.0×10⁻5/K。炎色反応は深紅色でスペクトル線は6707.9Å。電気的陽性の強い1価の元素で,化学的性質は他のアルカリ金属に似ているが,マグネシウム,カルシウムなどのアルカリ土類金属に似ている点も多い。たとえば,フッ化物,炭酸塩,リン酸塩が水に難溶で,塩は潮解性のものが多い。金属は乾いた空気中,常温ではほとんど酸化されないが,200℃以上では燃えて酸化リチウムLi2Oになる。赤熱状態で水素と化合して水素化リチウムLiH,窒素と化合して窒化リチウムLi3Nを生ずる。ハロゲン,硫黄とも直接化合する。炭素,ケイ素とも反応する。常温で水を分解するが,反応はカリウム,ナトリウムほど激しくない。強酸水溶液と激しく反応して水素を発生し,塩を生ずる。濃硫酸には徐々に溶ける。メチルアルコール,エチルアルコールには水素を発生して溶解し,対応するアルコキシドLiOCH3,LiOC2H5を生ずる。液体アンモニアに溶け(-33℃で100gに11.3g),溶媒和電子e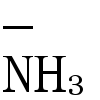 の光吸収にもとづく青色を呈する。石油,パラフィンに不溶。空気による酸化を避けるため石油中に密閉して蓄える。
の光吸収にもとづく青色を呈する。石油,パラフィンに不溶。空気による酸化を避けるため石油中に密閉して蓄える。
製法
工業的には,鉱石を処理して純粋な無水の塩化リチウムとし,溶融塩電解してつくられる。
用途
消費量の大きなものはステアリン酸リチウムで,自動車用その他のグリースとして用いられている。またホウロウ,強化ガラスなどに炭酸リチウムが,鉛,アルミニウム,マグネシウムなどとの合金が軸受,高強度軽合金などとして用いられている。宇宙カプセル中での二酸化炭素吸収に水酸化リチウムが,LiH,LiAlH4は還元剤あるいは水素発生用に用いられている。またリチウムまたはその化合物を陰極として用いるリチウム電池が開発されつつある。
執筆者:藤本 昌利
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「リチウム」の意味・わかりやすい解説
リチウム
りちうむ
lithium
周期表第1族に属し、アルカリ金属元素の一つ。
歴史
リチウムを含む鉱石、葉長石とリチア輝石は、1790年から1800年にかけて、スウェーデンのウテUtö島でアンドラダJose de Andradaによって発見されている。この葉長石の中に新しいアルカリ金属元素が含まれていることをみいだしたのはスウェーデンのアルフェドソンJohan August Arfvedson(1792―1841)で、1817年であった。リチウムの名は、ギリシア語の石lithosにちなんで、アルフェドソンの指導者ベルツェリウスによって提案された。ナトリウムやカリウムが植物関連物質からみいだされたのに対し、リチウムが鉱石からみいだされたことに基づいている。1818年W・TブランデBrandéとH・デービーは酸化リチウムを電解して少量のリチウム金属を単離しているが、物性の測定ができるほどの量を初めて得たのは、ドイツのブンゼンとイギリスのマチーセンAugustus Mathiessen(1831―1870)で、塩化リチウムの融解電解によって1855年に成功している。
[鳥居泰男]
存在
岩石や天然水の中に微量ではあるが広く分布している。動植物界たとえば海藻、タバコ、コーヒー、牛乳、血液などにも存在が認められる。工業資源として重要な鉱石はリチア輝石AlLi(SiO3)2、紅雲母(うんも)AlKLi2(FeOH)2(Si4O10)、葉長石AlLi(Si2O5)2、アンブリゴ石AlPO4・LiFなどである。天然塩水で数百ppmを含むものがアメリカのカリフォルニア州、ネバダ州などでみいだされており、資源として注目される。
[鳥居泰男]
製法
原鉱を硫酸、炭酸ナトリウム、塩酸などで処理して塩化リチウムとし、これに塩化カリウムを加えて融解電解することによって製造される。ピリジン、エタノール(エチルアルコール)、アセトンなどの中で塩化リチウムを電解する方法も行われる。
[鳥居泰男]
性質と用途
銀白色の軟らかい金属で、全金属元素中もっとも軽い。アルカリ金属元素の典型的な性質をもっていると同時に、ナトリウム以下とはかなり異なった性格を示し、むしろ、周期表で対角関係にあるマグネシウムに似た点も多い。乾燥空気中では安定でほとんど酸化されないが、熱すれば強い光を放って反応し酸化物Li2Oを与える(一般のアルカリ金属は過酸化物、超酸化物を与える)。
4Li+O2→2Li2O
室温でも窒素と反応して窒化物Li3Nを生成する(他のアルカリ金属は直接反応しない)。室温で水を分解して水素を発生するが、カリウムやナトリウムほど激しく作用しない。
2Li+2H2O→2LiOH+H2
高温でガラスと反応するので蒸留精製には鉄製容器が必要である。赤色の炎色反応を示す。この炎色反応を初めて観察したのは、ドイツのC・G・グメーリンであった(1818)。
金属として原子炉材料、有機合成の重合触媒などに用いられるほか、各種合金の添加剤、鋼材、合金の脱酸剤などとして最近その重要性が増している。
[鳥居泰男]
リチウム(データノート)
りちうむでーたのーと
リチウム
元素記号 Li
原子番号 3
原子量 6.941±3
融点 180.54℃
沸点 1350℃
比重 0.534(測定温度20℃)
結晶系 立方
元素存在度 宇宙 45(第32位)
(Si106個当りの原子数)
地殻 20ppm(第31位)
海水 0.18×103μg/dm3
化学辞典 第2版 「リチウム」の解説
リチウム
リチウム
lithium
Li.原子番号3の元素.電子配置1s22s1の周期表1族元素.原子量6.94.安定同位体 6Li,7Li,ほかに3種類の放射性同位体がある.1817年J. Berzelius(ベルセリウス)の弟子J.A. Arfwedsonがペタル石(petalite,LiAlSi4O10)中に発見し,Berzeliusがギリシア語の岩石λιθο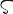 (lithos)から命名した.宇田川榕菴は天保8年(1837年)出版の「舎密開宗」で,利知烏母(リチウム)と記載している.
(lithos)から命名した.宇田川榕菴は天保8年(1837年)出版の「舎密開宗」で,利知烏母(リチウム)と記載している.
1855年R.W.E. Bunsen(ブンゼン)とA. Mathiessenが塩化物の融解電解によりはじめて金属を遊離した.天然には,リチア雲母,ペダル石,リチア石などの鉱石や岩石中に広く分布する.地殻中の存在度13 ppm.最大資源国はボリビアで推定埋蔵量540万t.次いでチリ300万t.おもに炭酸リチウムとして輸入され,2006年度の輸入量は14000 t で,約1万t がチリから.塩化リチウムの融解電解で得られる.真空蒸留により精製する.銀白色の軟らかい金属.体心立方格子構造.格子定数a = 0.350 nm(20 ℃).融点180.5 ℃,沸点1350 ℃.密度0.534 g cm-3(20 ℃).第一イオン化エネルギー5.390 eV.炎色反応は深紅色.常温,乾いた空気中では酸化されない.高温では酸素,窒素,水素,ハロゲン,硫黄,炭素,ケイ素などと直接化合する.常温の水や酸と反応して水素を発生し,水酸化物や塩を生じる.化合物においてはつねに酸化数1をとる.リチウムやリチウム化合物の化学的性質は,マグネシウムに似ている点が多い.これは Li+ が Mg2+ とほぼ同じ大きさをもつためである.
重合触媒(アルミニウム-リチウム合金),合金添加物,リチウムイオン電池用電極材,半導体材料,脱酸剤として用いられる.リチウムイオン電池用が最大・最重要用途である.[CAS 7439-93-2]
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「リチウム」の意味・わかりやすい解説
リチウム
lithium
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
百科事典マイペディア 「リチウム」の意味・わかりやすい解説
リチウム
→関連項目原子爆弾
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典 「リチウム」の解説
リチウム
世界大百科事典(旧版)内のリチウムの言及
【軽金属工業】より
…金属工業のうち,比重の比較的小さい金属,すなわち軽金属を扱う工業。軽金属には,アルミニウム,マグネシウム,チタン,ベリリウム,リチウムなどがあるが,とくにアルミニウムは鉄に次いで生産量が多く,軽金属の代表であるので,ここではアルミニウム工業を中心に述べる。
[アルミニウム]
原鉱石(ボーキサイトなど)からアルミナAl2O3を製造する化学的工程と,その電解工程(アルミ1t当り約1万5000kWhを要する)の2過程を要する高度な電気化学工業で,その発達には苛性ソーダ,フッ化物,電力など関連工業の発達,高品位の原鉱石ボーキサイト(Al2O350%以上含有)と,豊富で安価な発電地帯を有することが条件となる。…
※「リチウム」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...



