翻訳|isotope
精選版 日本国語大辞典 「同位体」の意味・読み・例文・類語
どうい‐たいドウヰ‥【同位体】
改訂新版 世界大百科事典 「同位体」の意味・わかりやすい解説
同位体 (どういたい)
isotope
原子番号が同じで質量数が異なる核種を,互いに同位体という。周期表で同じ位置に入る元素という意味で,同位元素ともいう(ギリシア語で,isosは〈同じ〉,toposは〈場所〉という意味)。またアイソトープともいう。これまでに知られている原子の種類は千数百あるが,これを分類整理するのには,原子の重さ,すなわち質量数(原子核中の陽子と中性子の数の和)よりも,原子番号,すなわち原子核中の陽子の数または中性原子の核外電子数によるほうが便利である。これは,原子の化学的性質が核外電子配置に最も大きく支配されるからである。このようにしてまとめたのが約100種の元素である。したがって同じ元素の原子でも質量数の違うものがあるのが普通で,それらの核種を互いに同位体の関係にあるといっている。このように同位体とは核種の間の関係を表す語であって,核種そのものを指すわけではないが,実際には混用されている。同位体は,元素記号では記号の左上にその質量数をつけて区別する。たとえば,12Cと13C,14Cなどと表す。これに対し,元素としては異なるものであっても質量数の同じ原子もあるわけで,そのような場合は同重体といっている。
分子内の原子をその同位体で置換したとき,各種の化学的あるいは物理的な性質に違いが生じてくることを同位体効果という。同位体は原子番号が同じ原子で,化学的性質はほとんど変りがないので,通常の化学反応では同位体効果はほとんどみられず,加水分解,イオン交換,酸化・還元,電気分解などでわずかな違いがみられるにすぎないが,気体の拡散,遠心分離,蒸留,電磁場内でのイオンの運動などの物理的挙動での効果はかなりな程度みられる。とくに原子番号の小さい元素ほど著しく表れ,水素では1H以外に,重水素deuterium2H,三重水素tritium3Hという別の名称が与えられるほどである。
同位体は1906年アメリカのボルトウッドB.B.Boltwoodによって,当時イオニウムIoと呼ばれていたウラン系列に属する放射性元素がトリウム232Thと同じ化学的性質を示すことからその同位体230Thであることを発見されたのが初めである。同位体のうち不安定で放射能をもち,崩壊するものを放射性同位体,安定で崩壊しないものを安定同位体あるいは非放射性同位体といっている。放射性同位体には,天然に存在する天然放射性同位体と人工的につくられた人工放射性同位体がある。天然に存在する元素では,多くの場合いくつかの同位体が存在するが(ベリリウム,フッ素,ナトリウム,アルミニウム,リンなどは一つしかない),それらの組成は地球上のどこへ行ってもほぼ一定の割合となっている。このような同位体の存在量を原子百分率で表したものを核種存在比といっている(各元素の核種存在比は各元素の項に示してある)。
放射性同位体
放射能をもつ同位体で,ラジオアイソトープともいい,RI(radioactive isotopeまたはradioisotopeからきている)という略号で呼ばれることが多い。天然に存在するもののほかに,人工的に各種の核反応を用いて,すべての元素に対して人工放射性同位体がつくられている。
原子番号の大きい天然放射性同位体には,ウラン系(238Uから出発して206Pbとなる系列),トリウム系(232Thから出発して208Pbとなる系列),アクチニウム系(235Uから207Pbとなる系列)などの崩壊系列をつくるものがある。宇宙ではじめて元素がつくられたときにはきわめて多くの放射性および非放射性の核種が存在していたと考えられるが,半減期が比較的短いものはこれまでに崩壊してしまい,半減期の長い核種のみが残り,またそれらから生ずる各種の放射性核種が残って地球上に天然に存在しているものとされる。天然放射性同位体は上記3系列のもののほかに,40K,87Rb,115In,138La,144Nd,147Sm,176Lu,180W,187Re,190Pt,209Biなどが知られている。これらは崩壊系列の起点をなす238U,235U,232Thとともに109年以上の半減期をもつため,現在まで残存しているものである。このほか,宇宙線などによる核反応などで,窒素から生ずる14Cや,あるいは3Hなどの誘導放射性核種も天然に存在するが,これらは天然放射性同位体には含めないのが普通である。
人工放射性同位体は,天然には存在せず,原子炉,サイクロトロン,シンクロトロンその他の各種加速器などを用い,各種の核種にα粒子,陽子,重陽子,中性子などを衝撃させてつくられる。1934年フランスのジョリオ・キュリー夫妻によって,ホウ素,マグネシウム,アルミニウムなどの軽元素の原子核に,ポロニウムのα粒子(ヘリウムHeの原子核)を衝撃させてつくられたのが初めである。これらの反応は次のようである。式中t1/2は半減期を表す。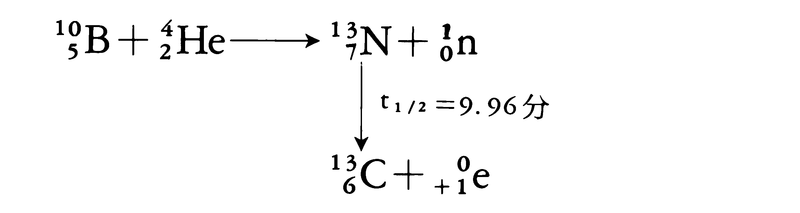
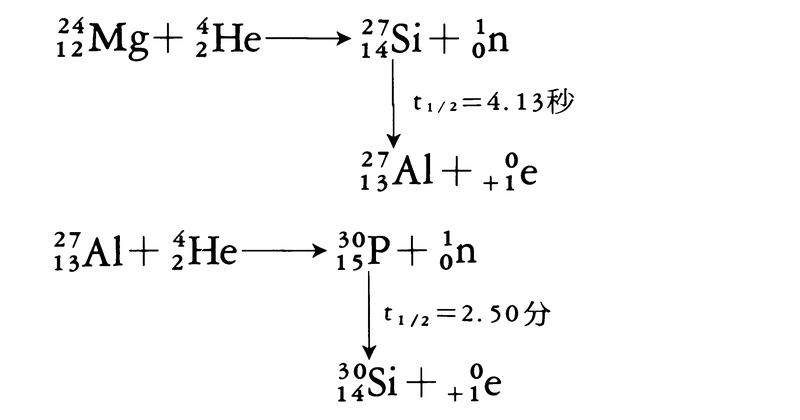
現在では加速器を用い,高エネルギーの加速粒子によって1000種以上の各種同位体がつくられている。たとえば,α粒子,陽子(p),重陽子(d),中性子(n)などの衝撃では次のような反応が起こる。
中性子照射は原子炉内で行われるが,原子炉内の中性子には,遅い中性子すなわち運動エネルギーの小さい中性子と,速い中性子すなわち運動エネルギーの大きい中性子とがあり,それぞれ(n,γ)型(中性子をとり込みγ線を放出する)および(n,α)型(中性子をとり込み,α粒子を放出する)の反応をする。天然に存在しない元素はたとえば次のようにしてつくられる。
(1)アメリシウムAm 23982Uを高速α粒子(40MeV)で衝撃する。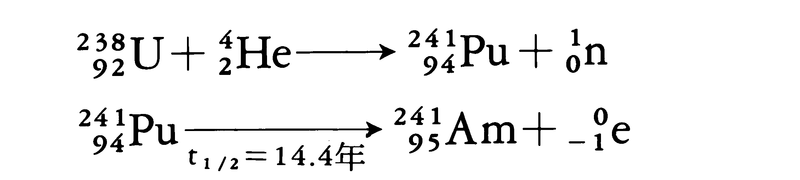
(2)カリホルニウムCf 23982Uに加速した炭素イオンで衝撃する。 (3)104番元素 24924Puをネオンイオンで衝撃する。
(3)104番元素 24924Puをネオンイオンで衝撃する。

安定同位体
放射能をもたない同位体。ある元素の天然における安定同位体の存在比は一定で,このためその元素の原子量は一定の値をとることになる。安定同位体は,1913年イギリスのJ.J.トムソンがネオンに20Neと22Neの二つの同位体があることを見いだしたのが初めである。現在では各種の安定同位体が質量分離器などで分離されたり,拡散法などで濃縮され,あるいは核反応などで製造されている。
同位体の分離,濃縮
同位体は化学的性質がきわめてよく似ているので,主として物理的性質の差を利用して分離あるいは濃縮する。同位体分離は1913年イギリスのF.W.アストンが気体拡散法によって20Neと22Neを分離したのが初めである。同位体分離法にはいろいろあるが,いずれも同位体効果を利用したものであり,分別蒸留,同位体交換,気体拡散,遠心分離,電解分離,ノズルによる気体噴散などの方法が主として用いられている。たとえば重水素は,水の電解分離,同位体交換法などが用いられる。電解分離は,33年アメリカのG.N.ルイスらが古い電解槽の水を連続的に電解して少量の重水を得たのに始まり,現在でもこの方法が用いられている(軽い同位体ほど速く電解されるので,重水が残る)。蒸気圧または沸点の差を利用して同位体を分解する分別蒸留分離法では,一般に重い同位体を含む分子ほど沸点が高いことを利用しており,37年オランダのケーソムW.H.Keesomらがネオンの同位体分離に,アメリカのH.C.ユーリーらが液体水素の分別蒸留により重水素の濃縮に成功したことに始まる。遠心分離機内に少量の液体を入れると,軽い同位体が気体となって回転軸付近に集まるので,これを利用して蒸発遠心分離法が開発され,35Clと37Clが39年ビームスJ.W.Beamsらによって初めて分離された。ガス拡散の速度差を利用する気体噴散法では,UF6の気体を用いて235Uをとり出している。最近ではレーザーによる同位体分離laser isotope separation(略称LIS)が開発され,235Uの分離に用いられている。完全に分離するのではなくて,分離過程で目的とする核種の濃度が増加するのを濃縮といい,濃縮された同位体を濃縮同位体という。たとえば原子炉燃料用などに用いる濃縮ウランなどがそうである。
同位体の利用
各種の利用法があるが,おもなものを挙げる。
(1)トレーサー 同位体トレーサーは,目的とする元素と化学的・物理学的・生物学的性質が同じであり,同位体効果があるだけというのが特徴である。これによって複雑な化学変化や生物学的変化を追究することができる。この場合同位体は,安定同位体であっても放射性同位体であってもかまわない。安定同位体の場合には質量分析計で質量を測定しなければならないが,放射性同位体では一般にその放出する放射能を測定するだけでよいという利点がある。また放射性同位体では,微量のトレーサーで放射能測定によって鋭敏に検出,定量ができる。現在ほとんどすべての元素についてトレーサーとして利用できる同位体が知られている。
(2)放射性同位体線源 α線,β線,γ線,X線,ポジトロン,中性子などの線源として,各種放射性同位体が用いられている。これらは医学,生物学,化学,物理学その他工業的にも広く用いられている。
(3)分析 一般的にトレーサーを用いての分析が行えるが,そのほかにも同位体希釈分析(サブストイキオメトリー)や放射化分析,同位体希釈マススペクトロメトリー,ラジオガスクロマトグラフィーなど多くの分析法に用いられている。
(4)年代測定 高エネルギー陽子を主とする一次宇宙線が大気に突入して二次宇宙線を発生し,その中性子が大気中の窒素と核反応を起こして放射性炭素14Cを生成する。これは大気上層部で起こるが,14Cは大気中の酸素と結合して14CO2となり,徐々に対流圏に入り,大気中に広く分布する(14Cは半減期5730±30年でβ崩壊して14Nとなる)。宇宙線による14Cの生成速度が一定であれば,壊変による減少や,海水に溶けることによる減少との間に平衡が成立し,大気中の14Cの濃度は一定になる。植物は光合成により大気中の二酸化炭素をとり込むが14CO2もいっしょにとり込む。したがって生きている生物体ではつねに14C/12Cが大気中の値と同じであるが,死んだ生物体では14Cの崩壊にともなってその比が減少することになる。これを利用して14Cが生体内に入ったときの年代測定を行うことができる。そのほか岩石中に存在する87Srを利用するルビジウム・ストロンチウム年代測定法,鉛同位体年代測定法,サマリウム・ネオジム系測定法など各種の方法がある。
→同位体分離 →年代決定法 →放射性同位体
執筆者:中原 勝儼
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
百科事典マイペディア 「同位体」の意味・わかりやすい解説
同位体【どういたい】
→関連項目アイソトープ|質量数
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「同位体」の解説
同位体
ドウイタイ
isotope
原子核中の陽子の数は同じであるが,中性子の数が異なる核種を互いに同位体という.陽子の数が同じなので同じ原子番号をもち,元素の周期表では同じ位置を占める.同位元素あるいはアイソトープともいう.ギリシア語のisos(同じ)とtopos(場所)に由来する.同位体のうち,放射性崩壊するものを放射性同位体(ラジオアイソトープ,RI),安定なものを安定同位体という.放射性同位体の発見は,1906年,B.B. Boltwoodが,イオニウムIo(233Th)がトリチウムと同じ性質をもつことを見いだしたことによる.安定同位体は,1912年,J.J. Thomsonが陽極線分析において,ネオンの同位体 20Ne,22Ne を発見したのが最初である.同位体どうしの化学的性質はほぼ同じだが,質量数,原子核の形,サイズ,スピンなどが異なることによって化学的挙動に差が現れる.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
最新 地学事典 「同位体」の解説
どういたい
同位体
isotope
同一の元素で,原子の質量の異なるもの。アイソトープ,同位元素とも。元素記号の左肩に質量数を記して区別。同一の元素では陽子の数が一定なので,同位体の間では中性子の数が異なる。例えば16Oと18Oでは,陽子の数は8,中性子の数が各8と10。陽子と中性子の数の組合せにより安定な同位体と不安定な同位体がある。後者は崩壊し,そのとき放射線を放出するので放射性同位体と呼ばれる。
執筆者:松葉谷 治
出典 平凡社「最新 地学事典」最新 地学事典について 情報
日本大百科全書(ニッポニカ) 「同位体」の意味・わかりやすい解説
同位体
どういたい
栄養・生化学辞典 「同位体」の解説
同位体
ブリタニカ国際大百科事典 小項目事典 「同位体」の意味・わかりやすい解説
同位体
どういたい
「アイソトープ」のページをご覧ください。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
世界大百科事典(旧版)内の同位体の言及
【原子】より
…例えば,水素原子ではZ=1なので原子番号は1,酸素原子ではZ=8なので原子番号は8である。 電荷数Zが等しくて,質量数Aが異なる原子核を同位核と呼び,そのような核をもつ原子を同位体(アイソトープ)と呼ぶ。同位体は化学的にはほとんど同じ性質をもつので,同じ元素名で呼ばれる。…
※「同位体」について言及している用語解説の一部を掲載しています。
出典|株式会社平凡社「世界大百科事典(旧版)」
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

