精選版 日本国語大辞典 「不可逆変化」の意味・読み・例文・類語
改訂新版 世界大百科事典 「不可逆変化」の意味・わかりやすい解説
不可逆変化 (ふかぎゃくへんか)
irreversible change
物質系の状態変化において,ある状態Aから他の状態Bに移るときには,一般に系以外の外界にも変化を生ずる。この系を状態Bから再び状態Aに戻したとき(戻す過程はどのような過程でもよい),外界も元の状態に戻る変化を可逆変化といい,これに対して可逆でない変化を不可逆変化または非可逆変化という。例えば,高温の物体と低温の物体を接触させたとき,熱は高温の物体から低温の物体に移動し,低温の物体から高温の物体に自然に移ることはありえない。すなわち,この変化は不可逆変化である。また摩擦による熱の発生も典型的な不可逆変化の例である。一般に物質系に生ずる変化は不可逆変化であって,可逆変化は摩擦や拡散,熱伝導などのない理想的な変化といえる。不可逆変化は,熱力学第2法則の一つの表現であり,また,〈仕事が熱に変わる現象は,それ以外に何の変化も残さないなら不可逆である〉というトムソンの原理と等価であることが証明されている。つまり,一つの熱源だけから,熱をとり,それを全部仕事に変えることは不可能である。
不可逆変化を特徴づける重要な概念としてエントロピーがある。すなわち,孤立系(断熱的な系)では,エントロピーの変化がなければ可逆変化であり,不可逆変化ならば必ずエントロピーは増大する(エントロピー増大の原理)。つまりエントロピーとは状態量であるから,二つの状態AとBの間にエントロピーの差,
⊿S≡SB-SA>0
があるとき,断熱的にAからBに移る過程は,必ず不可逆変化である。もちろん,熱⊿Qを与えてAからBに可逆変化で移ることもできる。そのときは,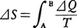 の関係が成立する。
の関係が成立する。
一般に,エントロピーは体系の乱雑さの度合を表す量であるから,エントロピー増大の原理は,〈系は,そのままにしておくと,自然に,より乱れた状態に移る〉ことを表している。高温の物質は低温の物質よりその構成粒子がより激しく運動しており,したがってそれだけ乱れ方が大きく,高温の状態のほうがエントロピーが大きい。
→エントロピー →可逆変化
執筆者:鈴木 増雄
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報
日本大百科全書(ニッポニカ) 「不可逆変化」の意味・わかりやすい解説
不可逆変化
ふかぎゃくへんか
irreversible change
もとへ帰ることができない変化のことであって、不可逆過程ともいう。正確には、一つの体系(物体系)の状態が変化するとき、その体系だけでなく、その体系の外部もまったく始めの状態に帰る方法が一つもないとき、この体系の状態の変化は不可逆変化である。可逆変化が正確に定義されておれば、そうでない変化が不可逆変化である。
いま一つの体系の状態が不可逆的に変化するとする。このとき体系が、温度がTである熱源から微小な熱量d′Qを吸収し、体系のエントロピーSがdSだけ変化するとすると、熱力学第二法則により、d′Q/T<dSという不等式が成立する。この体系が外界と熱的に絶縁されていると、d′Q=0であるから、dS>0であり、Sはかならず増大する。自然界におこる変化は厳密にはすべて不可逆である。したがって、外界から熱的に遮断された体系では、なんらかの変化がおこるたびに、この体系のエントロピーは増大を続ける。これをエントロピー増大の法則という。このことから、外界から熱的に絶縁された体系が熱平衡状態に達して、もはやどのような変化もおこらなくなると、この体系のエントロピーは最大値をとるということもすぐいえる。
普通の熱力学はほとんど可逆変化だけを取り扱うが、不可逆変化を取り扱う熱力学は不可逆変化の熱力学とよばれる。これは非平衡状態の熱力学といってもよい。非平衡状態では、体系の状態は時間とともに刻々変化してゆくのであるが、ある時刻においては、空間的にみて一般には一様でない。しかし、十分小さい部分では近似的に平衡状態にあると考えることができる。これを局所平衡という。局所平衡にある微小部分については、先の不等式のかわりにdS=d′Q/T+(dS)irrが成立すると考える。(dS)irrは不可逆変化によってこの部分に生じたエントロピーである。この変化が微小な時間間隔dtの間におこったとして、この式の両辺をdtで割り、dS/dt=(d′Q/T)/dt+(dS/dt)irrとする。これはエントロピーバランスの式といわれ、(dS/dt)irrはエントロピー生成速度といわれる。熱伝導、電気伝導などは典型的な不可逆変化であるが、これらに対してエントロピー生成速度が具体的に議論されている。
[沢田正三]
百科事典マイペディア 「不可逆変化」の意味・わかりやすい解説
不可逆変化【ふかぎゃくへんか】
→関連項目オンサーガー|時間(物理)|熱力学の法則
出典 株式会社平凡社百科事典マイペディアについて 情報
化学辞典 第2版 「不可逆変化」の解説
不可逆変化
フカギャクヘンカ
irreversible change
熱力学的に可逆的でない系の変化をいい,自発的過程はすべてこれに属する.これに伴い,系と周囲のエントロピーは増加し,一方,温度と圧力が一定のもとでは,系の自由エネルギーは減少する.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
ブリタニカ国際大百科事典 小項目事典 「不可逆変化」の意味・わかりやすい解説
不可逆変化
ふかぎゃくへんか
「可逆変化」のページをご覧ください。
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
関連語をあわせて調べる
春になって暖かくなりかけた頃、急に寒さが戻って、地面などがまた凍りつく。《 季語・春 》[初出の実例]「七瀬御秡 同晦日也。〈略〉雪汁いてかへる」(出典:俳諧・誹諧初学抄(1641)初春)...

