改訂新版 世界大百科事典 「ホウ素」の意味・わかりやすい解説
ホウ(硼)素 (ほうそ)
boron
第ⅢB族に属する非金属元素。ホウ酸ナトリウム(ホウ砂borax)の形で太古から知られており,前2000年ころのバビロニアでは極東地域から輸入して金細工や溶接に利用していたらしく,またエジプトおよびローマなどではホウケイ酸ガラスの原料としても用いられていた。16世紀ころには加熱時に金属酸化物を融解する性質を利用し,融剤として用いられた。アルコールと混ぜて点火すると緑色炎を生ずる反応はホウ酸の定性分析に使われるが,これは1741年ポットJ.H.Pottによって見いだされたものである。しかし18世紀には,この現象は銅(緑の炎色反応を示す)がホウ酸ナトリウムの主要成分であると誤って解釈されていた。単体のホウ素を不純ながら単離したのは,1808年イギリスのH.デービー,フランスのJ.L.ゲイ・リュサックおよびテナーL.J.Thenard(1777-1857)であった。炭素に性質が類似しているという理由で,デービーがboraxとcarbonからboronと命名した。1912年ストックA.Stockがホウ素と水素のみの化合物ボランを初めて合成したが,40年代になってこの種の化合物の理論的・構造的根拠づけが行われるようになり,その後ホウ素の化学は急速にまた膨大なものに発展し,炭素の化学である有機化学にも匹敵する分野が確立した。20世紀中葉の化学で最も画期的であり,さらに今後の広範な進展が期待される。
→ホウ素化学
天然には単体としては存在しないが,四ホウ酸ナトリウムNa2B4O7の水和物,灰ホウ石colemanite Ca2B6O11・5H2O,ソウ灰ホウ鉱ulexite Na2B4O7・Ca2B6O11・16H2Oなど,多種の鉱物として広く分布している。最大の産地はカリフォルニアである。
性質
ホウ素は,600~1000℃では非晶質(アモルファス)ホウ素,1000℃付近ではα菱面体晶,1100~1200℃でβ菱面体晶,1150~1300℃で正方晶I,1280~1500℃で正方晶Ⅲと,多種の変態が存在する。結晶構造は,ホウ素原子12個を頂点にもつ二十面体が基礎となっている。α菱面体晶ではB-B原子間距離が1.73~1.79ÅのB12二十面体が配列し,各ホウ素原子は図のような五角錐六配位構造をとっている。その他のβ菱面体晶,正方晶も二十面体構造の異なるパッキングによって構成されている。ホウ素の物理的性質は,その多形現象および高純度単体が得にくいことを反映して,以前には信頼しうるデータが少なかった。電気抵抗はとくに不純物の存在に敏感であるが,常温でだいたい106Ωcmときわめて高く,また高純度ホウ素は通常p型半導体である。空気中常温では安定であるが,450℃くらいになると酸化物を生じはじめる。水素とは反応しない。二酸化炭素と暗赤色に加熱すると,ホウ酸と炭素を生ずる。塩酸に溶けない。濃硫酸と濃硝酸の2:1混合溶液は,ホウ素を溶かすのに最も有効である。また炭酸ナトリウム,または炭酸ナトリウム・硝酸ナトリウム混合物と融解することができる。
化合物としては次の五つの型がある。(1)ホウ素化物(Zn,Cd,Hg,Ga,In,Tl,Biのホウ素化物は得られていない),(2)水素化物およびその誘導体,(3)三ハロゲン化物とその付加化合物,(4)ホウ酸塩,ホウケイ酸塩などのオキソ酸塩,(5)有機ホウ素化合物およびB-N化合物。
ホウ素の安定同位体は10Bと11Bであるが,これらは質量に10%もの差があり,天然では化学作用における同位体効果が著しく,存在比が試料によって異なる。11B/10Bの値は3.92から4.31まで変動があり,ホウ素の原子量自体これを反映して高精度で決定しえない。また熱中性子に対する反応断面積は10Bが3837バーン,11Bが0.005バーンで大いに異なる。
ホウ素は高等植物における必須元素である。したがって動物中にも微量(1ppm以下)存在するが,動物栄養にも必要かどうかはわかっていない。不揮発性ホウ素化合物を粉塵(ふんじん)として吸入しても毒性はあまり高くなく,一時的炎症を起こす程度である。これに反して揮発性ホウ素化合物の吸入はきわめて危険で,中枢神経に障害を与える。
製法
単体のホウ素は無水ホウ酸をマグネシウムによって還元してつくる。またホウフッ化カリウムKBF4の溶融塩電解,三ハロゲン化ホウ素の水素還元によってつくられる。無水ホウ酸はマグネシウムで800℃付近の温度により,発熱反応で激しく還元されるが,生成されるホウ素にマグネシウムがホウ化物として含まれ,純度の高いホウ素が得られず,これを除く工程が必要となる。電解法は,KBF418%,KCl70%,KF12%の混合塩を750~800℃で,炭素を陽極,モネルメタルを陰極として行われる。三ハロゲン化ホウ素(とくにBBr3)の水素還元による方法では純度の高いものが得られる。とくに熱フィラメント法と称して,タンタル,炭素またはホウ素のフィラメントの上で水素ガスと1300~1850℃に加熱すると,純度99.9%のホウ素が得られる。このとき,温度が高く,三ハロゲン化ホウ素の濃度が低いほど,生成物の結晶性がよい。
用途
ホウ素は鉄鋼の添加剤とされ,少量の添加で鋼の脱酸とともに結晶の微細化などが起こり,鋼の性質改善に有効である。モリブデン線またはタングステン線上にホウ素を気相から析出させてつくったホウ素繊維の強化型合金は,強力軽量の構造材として航空機工業で用いられている。鉄-コバルト-ホウ素,鉄-ニッケル-ホウ素合金は非晶質となりやすく,その特性を生かした用途が開発されつつある。熱中性子反応は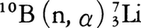 と表されるが,これは中性子検出用ボロンカウンターに利用されている。またこの反応において2.4MeVのエネルギーをもつγ線が放出される。脳腫瘍患者にホウ素化合物を注射して癌細胞に集め,中性子を照射し,そのγ線によって癌細胞を破壊する治療法が行われている。
と表されるが,これは中性子検出用ボロンカウンターに利用されている。またこの反応において2.4MeVのエネルギーをもつγ線が放出される。脳腫瘍患者にホウ素化合物を注射して癌細胞に集め,中性子を照射し,そのγ線によって癌細胞を破壊する治療法が行われている。
ホウ酸塩としての用途も多く,洗剤,ハンドクリーム,ローションなどに使われる。またホウケイ酸ガラスは熱膨張係数が小さいので耐熱性が強く,たとえばパイレックスなどの商品名で広く使用されている。
執筆者:水町 邦彦+後藤 佐吉
原子炉材料としてのホウ素
中性子吸収断面積が大きいことから,中性子吸収材として原子炉の制御に利用されている。ホウ素の同位体のうち11Bはほとんど中性子を吸収せず,存在比が約19%の10Bがきわめて大きな熱中性子吸収断面積をもっている。実際の使用形態としては,炭化物B4Cの粉末をステンレス鋼管の中に封入して沸騰水型軽水炉の制御棒に,また,加圧水型軽水炉の冷却水にホウ酸を溶かし,その濃度を調節することによって出力の調整に,あるいは,ホウ素を含む鋼としてガス冷却炉の出力調整に使用する例などがある。
執筆者:大久保 忠恒
出典 株式会社平凡社「改訂新版 世界大百科事典」改訂新版 世界大百科事典について 情報




 母(ボリュウム),ボラキス・ストフとしている.ホウ酸またはホウ砂などのホウ酸塩の形で昔から知られていた.
母(ボリュウム),ボラキス・ストフとしている.ホウ酸またはホウ砂などのホウ酸塩の形で昔から知られていた.